题目内容
【题目】某实验小组尝试在钢制钥匙上镀铜。
实验I:将钥匙直接浸入0.4 mol·L-1 CuCl2溶液中,20s后取出,钥匙表面变红,但镀层疏松,用纸即可擦掉。
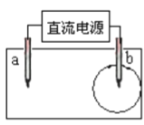
实验II:用图装置对钥匙进行电镀铜。钥匙表面迅速变红,同时有细小气泡产生,精铜表面出现少量白色固体。30s后取出钥匙检验,镀层相对实验I略好,但仍能用纸巾擦掉一部分。经调整实验条件后获得了较好的电镀产品。
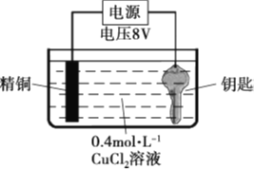
实验III:用0.4 mol·L-1 CuSO4溶液代替CuCl2溶液重复实验II,精铜表面未出现白色固体。
回答下列问题:
(1)实验I反应的化学方程式是_______。
(2)实验II中钥匙应与电源的_______极连接。
(3)钥匙表面产生的气体是_______。
(4)为了避免实验III中钥匙表面产生气体,应该采取的措施是________。
(5)常见化合物中铜元素有+1、+2两种价态,结合实验III推测实验II中精铜表面产生的白色固体的电极反应式是________。(已知CuOH是一种难溶于水的黄色固体)
【答案】Fe+CuCl2 =Cu+FeCl2 负 H2 适当降低c(H+)或降低电源电压(其他答案合理给分) Cu-e- +Cl- =CuCl
【解析】
本题主要考察电镀的原理,题中所涉及的气体、白色固体,需要结合所学知识去推测。
(1)钢制钥匙的主要成分是Fe,实验I的化学方程式是:Fe+CuCl2=FeCl2+Cu;
(2)实验II中,钥匙是要被镀铜,则应该做阴极,即与电源的负极连接;
(3)CuCl2溶液呈弱酸性,阴极上会有少量的H+放电形成H2,所以钥匙表面的气体为H2;
(4)为避免实验III中药匙表面产生气体,可以适当降低溶液中H+的浓度,或者适当降低电压;
(5)Cu(II)的化合物一般都是蓝色或绿色,Cu(I)的化合物中,已学的不溶于水的有Cu2O(砖红色)、CuOH(黄色)、CuCl(白色),则该白色固体为CuCl,则相应的电极反应式为:Cu-e- +Cl- =CuCl。