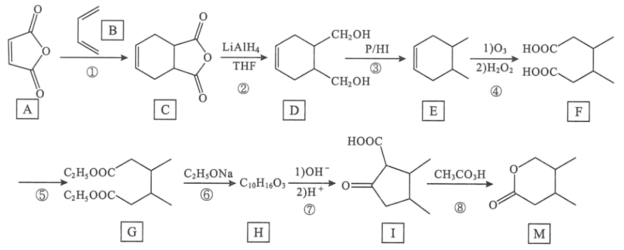
题目内容
【题目】50mL0.50 mol·L-1盐酸与50mL0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
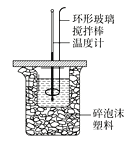
(1)大小烧杯间填满碎泡沫塑料的作用是_____。
(2)大烧杯上如不盖硬纸板,求得的中和热数值将____(填“偏大”“偏小”或“无影响”)。
(3)实验中改用60mL0.50 mol·L-1盐酸与50mL0.55mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量___(填“相等”或“不相等”),所求中和热____(填“相等”或“不相等”),简述理由___。
(4)若改用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会____(填“偏大”“偏小”或“无影响”)。
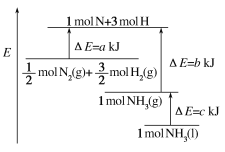
【答案】减少实验过程中的热量损失 偏小 不相等 相等 中和热是在稀溶液中,H+和OH-发生中和反应生成1 mol H2O时所放出的热量,与酸碱的用量无关 偏小
【解析】
(1)中和热测定需准确测定热量变化,尽可能防止热量损失;
(2)大烧杯上如不盖硬纸板,热量损失偏多;
(3)反应放出的热量和所用酸以及碱的量的多少有关;中和热是在稀溶液中,1 mol H+和1 mol OH-发生中和反应生成1 mol H2O时所放出的热量,与酸碱的用量无关;
(4)氨水是弱碱,电离吸热;
(1)中和热测定,尽可能防止热量损失,所以大小烧杯间填满碎泡沫塑料的作用是减少实验过程中的热量损失;
(2)大烧杯上如不盖硬纸板,热量损失偏多,求得的中和热数值将偏小;
(3)反应放出的热量和所用酸以及碱的量的多少有关,若用60 m L 0.50 mol·L-1盐酸与 50 m L 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,生成水的量不同,所放出的热量不相等,但因中和热是在稀溶液中,1 mol H+和1 mol OH-发生中和反应生成1 mol H2O时所放出的热量,与酸碱的用量无关,所求中和热相等;
(4)氨水是弱碱,电离吸热,若改用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会偏小。

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案