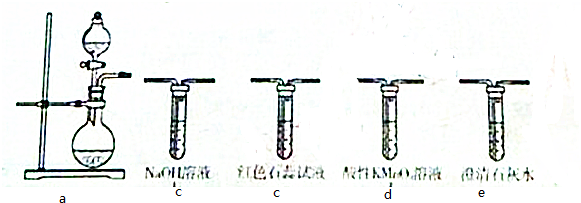
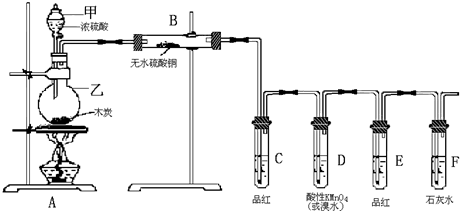
题目内容
19.(1)试写出以下每一步转化的反应方程式;(2)分写上述每一步反应中氮元素化合价,并指出氮元素发生的氧化反应还是还原反应.
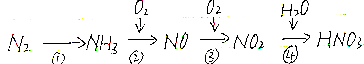
分析 (1)依据①反应为氮气和氢气合成氨的反应;②中生成的是两种氧化物可知其产物是一氧化氮和水;③依据该反应是化合反应可知产物中只有二氧化氮;④中还有一种产物是氮的氧化物,其中氮元素显示+2价,说明这种氮的氧化物应该是NO,据此书写;
(2)根据氮元素降低被还原发生还原反应,氮元素升高被氧化发生氧化反应判断.
解答 解:(1)依据流程中的物质的信息可知①为氮气和氢气合成氨的反应,方程式为N2+3H2$?_{催化剂}^{高温高压}$2NH3,②反应中生成的是两种氧化物可知其产物是一氧化氮和水,其方程式为:4NH3+5O2 $\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O;③依据该反应是化合反应可知产物中只有二氧化氮,其方程式为:2NO+O2=2NO2 ;④产物中除去硝酸之外还有一种氮的氧化物,其中氮元素显示+2价,说明这种氮的氧化物应该是NO;所以其方程式为:3NO2+H2O=2HNO3+NO;
答:①N2+3H2$?_{催化剂}^{高温高压}$2NH3;②4NH3+5O2 $\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O;③2NO+O2=2NO2;④3NO2+H2O=2HNO3+NO;
(2)由(1)各步反应为:①N2+3H2$?_{催化剂}^{高温高压}$2NH3,该反应中氮元素化合价由0价降低到-3价被还原发生还原反应;②4NH3+5O2 $\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O,该反应中氮元素化合价由-3价升高到+2价被氧化发生氧化反应;③2NO+O2=2NO2,该反应中氮元素化合价由+2价升高到+4价被氧化发生氧化反应;④3NO2+H2O=2HNO3+NO,该反应中氮元素化合价既有+4价升高到+5价,又有+4价降低到+2价,所以即发生氧化反应又发生还原反应;
答:①N2+3H2$?_{催化剂}^{高温高压}$2NH3,该反应中氮元素化合价由0价降低到-3价被还原发生还原反应;②4NH3+5O2 $\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O,该反应中氮元素化合价由-3价升高到+2价被氧化发生氧化反应;③2NO+O2=2NO2,该反应中氮元素化合价由+2价升高到+4价被氧化发生氧化反应;④3NO2+H2O=2HNO3+NO,该反应中氮元素化合价既有+4价升高到+5价,又有+4价降低到+2价,所以即发生氧化反应又发生还原反应.
点评 根据题目信息,找出反应物和生成物,再利用书写化学方程式的方法及步骤,根据质量守恒定律,正确书写化学方程式即可.

| X | ||
| Y | Z |
(1)这三种元素的元素符号:XC,YMg,ZAl.
(2)写出Y的单质在X的氧化物中燃烧的化学反应方程式:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(3)写出Z的氧化物分别与强酸溶液和强碱溶液反应的离子方程式:Al2O3+6H+=2Al3++3H2O、Al2O3+2OH-=AlO2-+2H2O.
| A. | 水 | B. | 食盐 | C. | 氯气 | D. | 氦气 |
| A. | 在氧化还原反应中,甲失电子比乙失电子多 | |
| B. | 甲在化合物中的化合价比乙在化合物中的高 | |
| C. | 甲能与稀盐酸反应生成氢气,而乙不能 | |
| D. | 甲与乙组成原电池时,甲为正极 |
| A. | C2H6O | B. | C3H6O | C. | C2H3Br | D. | C2H4 Br2 |