题目内容
5.镁是海水中含量较多的金属,镁、镁合金及其镁的化合物在科学研究和工业生产中用途非常广泛.(1)图1是2LiBH4/MgH2体系放氢焓变示意图,则:
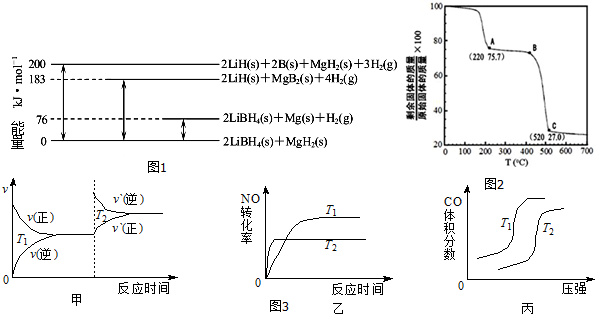
Mg(s)+2B(s)═MgB2(s)△H=-93 kJ•mol-1.
(2)工业上可用电解熔融的无水氯化镁获得镁.其中氯化镁脱水是关键工艺之一,一种正在试验的氯化镁晶体脱水的方法是:先将MgCl2•6H2O转化为MgCl2•NH4Cl•nNH3(铵镁复盐),然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为:MgCl2•NH4Cl•nNH3$\frac{\underline{\;700℃\;}}{\;}$MgCl2+(n+1)NH3↑+HCl↑;
电解熔融氯化镁,阴极的电极反应式为:Mg2++2e-=Mg.
(3)储氢材料Mg(AlH4)2在110-200°C的反应为:Mg(AlH4)2=MgH2+2A1+3H2↑每生成27gAl转移电子的物质的量为3mol.
(4)工业上用MgC2O4•2H2O热分解制超细MgO,其热分解曲线如图2.图中隔绝空气条件下B→C发生反应的化学方程式为MgC2O4$\frac{\underline{\;\;△\;\;}}{\;}$MgO+CO↑+CO2↑.
(5)CO与NO反应生成可参与大气循环的无毒气体,其热化学方程式为:2NO(g)+2CO(g)=2CO2(g)+N2(g);
△H=-746kJ•mol-1.对于该反应,温度不同(T2>T1)、其他条件相同时,图3中图象正确的是乙.
分析 (1)根据反应热的意义,由图可知:2LiBH4(s)+MgH2(s)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+200 kJ•mol-1①
2LiBH4(s)+MgH2(s)=2LiBH4(s)+Mg(s))+H2(g)△H=+76 kJ•mol-1②
2LiBH4(s)+MgH2(s)=2LiH(s)+MgB2(s)+4H2(g)△H=+183 kJ•mol-1③
2LiH(s)+MgB2(s)+4H2(g)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+(200-183)kJ•mol-1④,
应用盖斯定律计算化学反应的焓变;
(2)先将MgCl2•6H20转化为MgCl2•NH4Cl•nNH3,然后在700℃脱氨得到无水氯化镁,依据原子守恒书写化学方程式;
(3)根据方程式的意义:Mg(AlH4)2=MgH2+2Al+3H2↑,反应中生成2molAl转移电子6mol,据此计算即可;
(4)用MgC2O4•2H2O热分解制超细MgO,当最后固体完全为MgO时,可以计算剩余固体质量占原先固体质量的百分比,得到C点剩余的固体,MgC2O4•2H2O加热后先失去结晶水,完全失去结晶水后生成MgC2O4时,可以计算剩余固体质量占原先固体质量的百分比,最后根据氧化还原反应特点,写出反应的化学方程式;
(5)甲、升高温度,平衡正向移动,正逆反应速率都增大;
乙、升高温度,平衡正向移动;温度高的先拐,先达平衡;
丙、增大压强,平衡正向移动,据此判断CO的体积分数变化的情况.
解答 解:(1)由图可知:2LiBH4(s)+MgH2(s)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+200 kJ•mol-1①
2LiBH4(s)+MgH2(s)=2LiBH4(s)+Mg(s))+H2(g)△H=+76 kJ•mol-1②
2LiBH4(s)+MgH2(s)=2LiH(s)+MgB2(s)+4H2(g)△H=+183 kJ•mol-1③
2LiH(s)+MgB2(s)+4H2(g)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+(200-183)kJ•mol-1④
即:MgB2(s)+H2(g)=2B(s)+MgH2(s)△H=+17 kJ•mol-1④
所以-④-②得:Mg(s)+2B(s)═MgB2(s)△H=-(17+76)kJ•mol-1
故答案为:-93 kJ•mol-1;
(2)MgCl2•NH4Cl•nNH3,在700℃脱氨得到无水氯化镁,反应的化学方程式:MgCl2•NH4Cl•nNH3$\frac{\underline{\;700℃\;}}{\;}$MgCl2+(n+1)NH3↑+HCl↑↑;用惰性电极电解熔融氯化镁,阴极上是镁离子得到电子生成镁,电极反应为:Mg2++2e-=Mg;
故答案为:MgCl2•NH4Cl•nNH3$\frac{\underline{\;700℃\;}}{\;}$MgCl2+(n+1)NH3↑+HCl↑;Mg2++2e-=Mg;
(3)储氢材料Mg(AlH4)2在110℃-200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑,反应中生成2molAl转移电子6mol,每生成27gAl转移电子的物质的量为3mol,
故答案为:3mol;
(4)工业上用MgC2O4•2H2O热分解制超细MgO,当最后固体完全为MgO时,剩余固体质量占原先固体质量的百分比为:$\frac{40}{148}$×100%=27%,所以C点剩余的固体为MgO,MgC2O4•2H2O加热后先失去结晶水,完全失去结晶水后生成MgC2O4时剩余固体质量占原先固体质量的百分比:1-$\frac{36}{148}$×100%≈75.7%,说明A点恰好失去结晶水,则B点剩余固体为氧化镁和草酸镁的混合物,草酸镁中C的化合价为+3价,根据氧化还原反应特点可知,草酸镁分解生成一氧化碳和二氧化碳气体,反应的化学方程式为:MgC2O4$\frac{\underline{\;\;△\;\;}}{\;}$MgO+CO↑+CO2↑,
故答案为:MgC2O4$\frac{\underline{\;\;△\;\;}}{\;}$MgO+CO↑+CO2↑;
(5)升高温度,平衡正向移动,但是正逆反应速率是立即增大,离开原来的速率点,所以甲错误;
升高温度,平衡正向移动,一氧化碳的转化率减小,反应速率增大,温度高的先拐,先达平衡,故乙正确;
温度不变,增大压强,平衡正向移动,所以CO的体积分数减小,故丙错误.
故答案为:乙.
点评 本题综合考查学生热化学、电化学、化学反应速率和平衡移动的影响因素等知识,属于综合知识的考查,难度较大.

 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案| A. | 它是烃的衍生物 | B. | 它是含有三种元素的混合物 | ||
| C. | 它的相对分子质量为32 | D. | 它在空气中燃烧只生成CO2 |
| 100mL 盐酸 | 100mL 盐酸 | 100mL 盐酸 | |
| m(混合物) | 14.2g | 25g | 27.6g |
| V(CO2)(标况) | 3.36L | 4.48L | 4.48L |
| A. | 盐酸的物质的量浓度为3.0mol•L-1 | |
| B. | 加入混合物14.2g时盐酸不足 | |
| C. | 加入25g混合物时盐酸过量 | |
| D. | 根据表中数据计算出混合物中NaHCO3与KHCO3的物质的量之比是1:2 |
| A. | 14g | B. | 42g | C. | 56g | D. | 28g |
| A. | 水 | B. | 食盐 | C. | 氯气 | D. | 氦气 |
 有多种同分异构体,其中属于酯类且结构中含有苯环和甲基的同分异构体有( )
有多种同分异构体,其中属于酯类且结构中含有苯环和甲基的同分异构体有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |