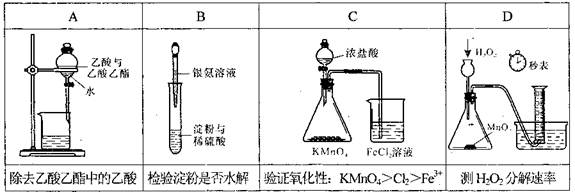
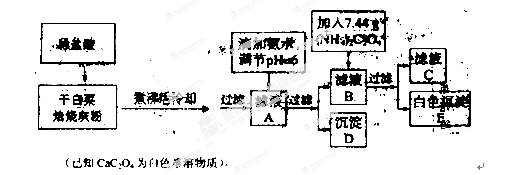
题目内容
下列有关实验的叙述,正确的是
| A.用碱式滴定管量取20.00mL KMnO4溶液 |
| B.用玻璃棒蘸取浓硫酸点在pH试纸上,测其pH |
| C.取用一小块钠后,剩余的钠放到垃圾桶里 |
| D.配制一定物质的量浓度的稀硫酸时,定容时俯视,则所配溶液的浓度偏高 |
D
试题分析:碱式滴定管活塞处有一段橡胶管,橡胶的主要成分含有碳碳双键,碳碳双键容易被高锰酸钾溶液氧化而腐蚀,因此不能用碱式滴定管量取高锰酸钾溶液,只能选择酸式滴定管,酸式滴定管活塞处是磨口玻璃,玻璃的主要成分是二氧化硅、硅酸盐,二氧化硅不能被高锰酸钾溶液氧化,只能与强碱反应,生成硅酸盐和水,则酸式滴定管不能盛碱性溶液,故A错误;浓硫酸具有强酸性和脱水性,它能先使pH试纸变红,后使其中的纤维素脱水碳化而变黑,因此不能能测定浓硫酸的pH,故B错误;钠是活泼金属,容易与空气中的氧气、水分、二氧化碳反应,放出的热量可能引起火灾,因此多余的钠应放回煤油中,隔绝空气保存,不能放到垃圾桶,故C错误;定容时平视,对溶液的体积无影响,若俯视,则溶液的体积偏小,由于c=n/V,所配溶液的浓度与溶液体积成反比例,则定容时俯视,导致所配溶液的浓度偏高,故D正确。

练习册系列答案
相关题目
 N2O4(无色),减压时,气体颜色变浅,平衡向正反应方向移动
N2O4(无色),减压时,气体颜色变浅,平衡向正反应方向移动

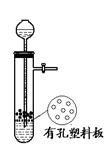
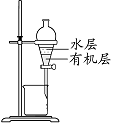
 图I 图II 图III 图IV
图I 图II 图III 图IV