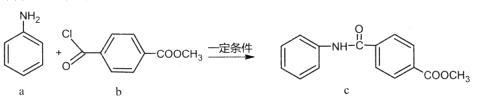
题目内容
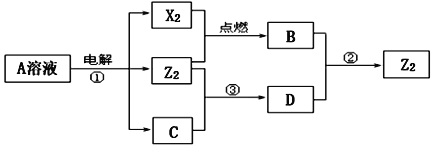
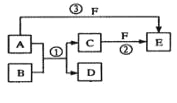
【题目】A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),其中反应①是置换反应,B、C、F都是气态单质,且B为黄绿色;反应③中有水生成,反应②需要放电才能发生,A和D相遇有白烟生成。
(1)反应③的化学方程式为:_________________;
(2)反应①中每生成1 molC,转移的电子数为______________;
(3)A与D的水溶液恰好完全反应时,其生成物的水溶液呈_____性(填“酸”“碱”或“中”),该水溶液中存在着如下关系,用粒子浓度符号填写。
①c(H+)+____= c(OH-)+ c(Cl-);
②c(H+)= c(OH-)+____;
(4)元素X与组成B的元素同周期,X的单质既可与酸反应也可与碱反应且都生成H2,则
①X的单质与碱反应的离子方程式_____________________________;
②X、空气、海水可以组成新型海水标志灯的电池。该电池以海水为电解质溶液,靠氧气使X不断氧化而源源不断产生电流,只要把灯放入海水中,数分钟后就会发出耀眼的闪光,其能量比干电池高20~50倍。则该新型电池的正极的电极反应式为________________;原电池的总反应方程式为________________________。
【答案】4NH3+5O2![]() 4NO+6H2O 3.612×1024或6NA 酸 c(NH4+) c(NH3·H2O) 2Al+2OH-+2H2O=2AlO2-+3H2↑ O2+2H2O+4e-=4OH- 4Al+3O2+6H2O=4Al(OH) 3
4NO+6H2O 3.612×1024或6NA 酸 c(NH4+) c(NH3·H2O) 2Al+2OH-+2H2O=2AlO2-+3H2↑ O2+2H2O+4e-=4OH- 4Al+3O2+6H2O=4Al(OH) 3
【解析】
B为黄绿色气体,应为Cl2,A和D相遇有白烟生成,根据反应转化关系可知A为NH3,D为HCl,反应②需要放电才能发生,说明C为N2,F为O2,则E为NO,结合题目要求和物质的性质可解答该题。
(1)反应③为NH3的催化氧化反应,方程式为4NH3+5O2![]() 4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(2)反应①中每生成1molC,即1molN2,转移的电子数目为2×3×NA=3.612×1024或6NA,故答案为:3.612×1024或6NA;
(3)A为NH3,D为HCl,反应生成NH4Cl,为强酸弱碱盐,溶液呈酸性,溶液中存在电荷守恒,则有c(H+)+c(NH4+)=c(OH-)+c(Cl-),溶液中存在质子守恒,则有c(H+)=c(OH-)+c(NH3·H2O),故答案为:酸,c(NH4+);c(NH3·H2O);
(4)①元素X与组成B的元素同周期,X的单质既可与酸反应也可与碱反应且都生成H2,X为Al,可与碱反应生成氢气,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
②海水、铝、空气电池中正极为氧气得到电子的反应,方程式为O2+2H2O+4e-=4OH-,负极为4Al+6H2O-12e-=4 Al(OH) 3,正负极反应相加可得总反应方程式为4Al+3O2+6H2O=4Al(OH) 3,故答案为:O2+2H2O+4e-=4OH-;4Al+3O2+6H2O=4Al(OH) 3。

 作业辅导系列答案
作业辅导系列答案【题目】CCUS是一种二氧化碳的捕获、利用与封存的技术,这种技术可将CO2资源化,产生经济效益。请回答下列问题:
(1)利用废气中的CO2为原料可制取甲醇。一定条件下,在恒容密闭容器中发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
①已知:H2(g)、CH3OH(1)的燃烧热(△H)分别为-285.8kJ·mol-1和-726.5kJ·mol-1;
CH3OH (1)===CH3OH (g) △H=+35.2kJ·mol-1;
H2O(1)===H2O(g) △H=+44kJ·mol-1。
则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=___________kJ·mol-1。有利于提高H2平衡转化率的条件是___________(填选项字母)。
CH3OH(g)+H2O(g) △H=___________kJ·mol-1。有利于提高H2平衡转化率的条件是___________(填选项字母)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
②某温度下,向体积为2L的容器中充入6molH2、4 mol CO2,发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),达到平衡时H2的转化率为50%,其平衡常数为___________(保留两位有效数字)。
CH3OH(g)+H2O(g),达到平衡时H2的转化率为50%,其平衡常数为___________(保留两位有效数字)。
③起始条件(T1℃、2L密闭容器)如表所示:
CO2/mol | H2/mol | CH3OH/mol | H2O/mol | |
I(恒温恒容) | 2 | 6 | 0 | 0 |
II(绝热恒容) | 0 | 0 | 2 | 2 |
达到平衡时,该反应的平衡常数:K(I)___________K(Ⅱ)(填“>”“<”或“=”,下同);平衡时CH3OH的浓度:c(I)___________c(Ⅱ)。
(2)CO2可用来合成低碳烯烃:2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) △H=-127.8 kJ·mol-1。0.1MPa下,按n(CO2)︰n(H2)=1︰3的投料比充入体积固定的密闭容器中,发生上述反应,不同温度(T)下平衡时的四种气态物质的质量分数(
CH2=CH2(g)+4H2O(g) △H=-127.8 kJ·mol-1。0.1MPa下,按n(CO2)︰n(H2)=1︰3的投料比充入体积固定的密闭容器中,发生上述反应,不同温度(T)下平衡时的四种气态物质的质量分数(![]() )如图所示:
)如图所示:
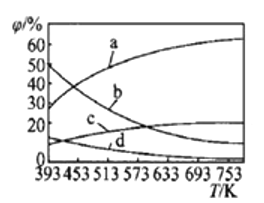
①曲线b、c表示的物质分别为___________、___________(填化学式)。
②保持温度不变,在体积为VL的恒容容器中以n(CO2)︰n(H2)=2︰3的投料比加入反应物,t0时达到化学平衡。t1时将容器体积瞬间扩大至2VL并保持不变,t2时重新达到平衡。请在图中画出容器内混合气体的平均相对分子质量M随时间的变化图象_________。