题目内容
X、Y、Z、T是元索周期表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X是地壳中含量最多的元素 |
| Y | Y元素原子核外3p能级上有4个电子 |
| Z | 核素Z的质量数为14、中子数为7 |
| T | T的单质是一种常见的金属,其新制的氢氧化物悬浊液可用于检验糖尿病 |
(2) X的电负性比Y______的 (填“大”或“小”);H-X, H-Y两种共价键中,键长较长的是______(用元素符号表示,下同)。
(3) Z的最高价氧化物对应水化物的稀溶液能与单质T反应,写出该反应的化学方程式,并标出电子转移的 方向和数目: __________________。
(4) 在250C、101 kPa时,若适量的Z2和X2完全反应,每生成30 g ZX需要吸收90 kJ热量。则该反应的热化学方程式为____________。
(1)四; ⅠB (各1分)
(2)大;H—S(各2分)
(3)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O (3分)
(4)N2(g)+O2(g)=2NO(g) ΔH=+180KJ/mol (3分)
解析试题分析:由题意可以推知X、Y、Z、T分别为O、S、N、Cu。
(2)同主族从上到小,非金属减弱,电负性减小,故X>Y;从上到下原子半径逐渐增大,故有H—O<H—S;
(3)铜与稀硝酸反应的产物为NO,电子转移的方向和数目宜用单线桥法(参考答案及2012高考为双线桥)
(4)该反应为N2和O2的反应,生成1molNO放出90KJ的热量,故有热化学方程式为N2(g)+O2(g)=2NO(g) ΔH=+180KJ/mol。
考点:以物质结构为基础,考查元素周期表结构、元素周期律、氧化还原反应及热化学反应方程式的书写。

练习册系列答案
相关题目
有X、Y、Z、W四种含14个电子的粒子,其结构特点如下:
| 粒子代码 | X | Y | Z | W |
| 原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
| 粒子的电荷数 | 0 | 0 | 两个负电荷 | 0 |
(1)A原子核外比X原子多3个电子,A的原子结构示意图是 。含lmolX的氧化物晶体中含有共价键数目为 。
(2)Z与钙离子组成的化合物的电子式为 。
(3)14gY完全燃烧放出的热量是141.5kJ,写出Y燃烧的热化学方程式 。
(4)组成W的元素最高价氧化物对应的水化物甲有下图所示转化关系(丁为金属单质,反应条件和其他物质已略)

①写出丁元素在周期表中的位置 。
②写出丁在高温下与水反应的化学方程式 。
③组成W的元素的简单氢化物极易溶于水的主要原因是 ,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为 。
下表所列是元素周期表部分短周期的主族元素
| | W | X | Y | |
| R | | | | Z |
已知R为地壳中含量最多的金属元素。
(1)写出Z的原子结构示意图________。
(2)W与氢原子形成6原子分子的结构简式_______。
(3)超细RX粉末被应用于大规模集成电路领域。其制作原理为R2Y3、X2、W在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1∶1;其反应的化学方程式为_______。
(4)X最高价氧化物对应水化物与X气态氢化物反应的生成物溶于水中,所得溶液离子浓度从大到小的顺序是_______。
(5)火箭发动机的燃料胼(N2H4)与氧化剂N2O4反应生成N2和水蒸气。
已知①N2(g)+2O2(g)=N2O4(l) △H1=—195kJ?mol—1
②N2H4(l) +O2(g)=N2(g)+2H2O(g) △H2=—534.2kJ?mol—1
写出肼和N2O4反应的热化学方程式______________。
(6)温度为T时,向2.0L恒容密闭容器中充入1.00 mol PCl5,反应PCl5(g)
 PCl3(g)+Cl2(g),经过一段时间(t)后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g),经过一段时间(t)后达到平衡。反应过程中测定的部分数据见下表:| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
相同温度下,起始时向容器中充入1.00 mol PC15、0.20 mol PCl3和0.40 mol Cl2,反应达到平衡前v(正) _______v(逆)(填“>”或“=”或“<”);原因是_______。
X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X原子的L层电子数是K层电子数的2倍 |
| Y | Y原子的最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的原子核 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(2)X的活泼性比Y的 (填“强”或“弱”);X和Y的气态氢化物中,较稳定的是 (写化学式)。
(3)写出Z2Y2的电子式 ,XY2的结构式 。
(4)在X原子与氢原子形成的多种分子中,有些分子的核磁共振氢谱显示有两种氢,写出其中一种分子的名称 。氢元素、X、Y的原子也可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式 。
不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示, x越大,其原子吸引电子的能力越强。 下面是某些短周期元素的x值:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)通过分析x值变化规律,确定Mg的x值范围:_______ < x(Mg) <_________。
(2)推测x值与原子半径的关系是________________________________;根据短周期元素的x值变化特点,体现了元素性质的_________________变化规律。
(3)分别指出下列两种化合物中氧元素的化合价:HClO_________,HFO________。
(4)经验规律告诉我们:当成键的两原子相应元素x数值的差值(Δx),当Δx>1.7时,一般为离子键,当Δx<1.7时,一般为共价键,试推断AlBr3中化学键类型是________________。
(5)预测元素周期表中,x值最小的元素位于______周期________族(放射性元素除外)。
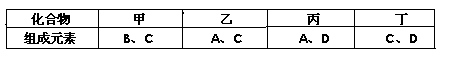

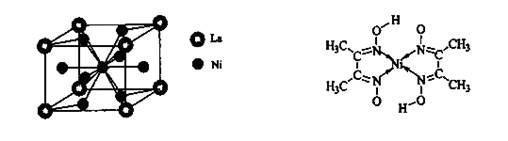
 键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;