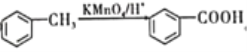题目内容
【题目】(1)向25mL沸水中逐滴加入5~6滴FeCl3饱和溶液;继续煮沸至溶液呈红褐色,停止加热可以制取Fe(OH)3胶体。试回答下列问题:
①写出此过程中的化学方程式:__;
②向所得Fe(OH)3胶体中逐滴滴加硫酸溶液,开始产生红褐色沉淀,继续滴加,沉淀最终消失且得棕黄色溶液,写出相关的离子方程式___;
(2)鸡蛋的内膜是一种半透膜,某同学拟用这种半透膜进行除去淀粉溶液中所含食盐的实验。设计步骤如下:
a.把鸡蛋的一头敲破,倒出蛋清、蛋黄,洗净蛋膜内部,将另一头浸泡在稀酸中溶去部分蛋壳(中间的蛋壳留着,起固定作用);
b.在一只小烧杯中加入适量蒸馏水,将洗净了蛋膜外部的蛋壳架在小烧杯上,蛋膜浸入蒸馏水中(如图);
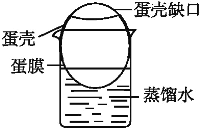
c.向蛋膜内加入淀粉和食盐的混合溶液,静置一段时间;
d.拿走蛋膜,检验烧杯中有无淀粉和食盐。
根据以上叙述,回答下列问题:
①步骤a中溶解蛋壳(主要成分为CaCO3)的酸最好是_____(填“盐酸”“硫酸”或“醋酸”)。
②检验烧杯中有无淀粉,操作是_____,检验烧杯中有无NaCl,操作是_____。
③为尽可能除去淀粉溶液里的食盐,可采取的措施是______(填入正确选项前的字母)。
A.换大烧杯,用大量水进行渗析
B.多次渗析,每次用水量不要太多
C.将蛋膜放在有流水的水槽中进行渗析
④如何证明淀粉溶液中的食盐有没有全部除去?简述实验过程:_____。
【答案】FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl Fe(OH)3+3H+=Fe3++3H2O 醋酸 取少量烧杯中液体,加入碘水看是否变为蓝色 另取少量烧杯中液体,加入几滴硝酸银溶液,看是否有白色沉淀生成 BC 加入硝酸银溶液,若无沉淀产生,则已全部去除
Fe(OH)3(胶体)+3HCl Fe(OH)3+3H+=Fe3++3H2O 醋酸 取少量烧杯中液体,加入碘水看是否变为蓝色 另取少量烧杯中液体,加入几滴硝酸银溶液,看是否有白色沉淀生成 BC 加入硝酸银溶液,若无沉淀产生,则已全部去除
【解析】
(1)①制备氢氧化铁胶体的方法:向25mL沸水中逐滴加入12mLFeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热,原理是:FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl;
Fe(OH)3(胶体)+3HCl;
②向氢氧化铁胶体中逐滴加入过量H2SO4溶液,H2SO4电离出的SO42使Fe(OH)3胶体发生聚沉,H+使Fe(OH)3沉淀溶解,会观察到先出现红褐色沉淀,后沉淀消失。发生的离子反应Fe(OH)3+3H+=Fe3++3H2O;
(2)溶液和胶体的本质区别就是分散质粒子的大小,利用其大小的差别可以用半透膜将溶质粒子(Na+、Cl-)和胶体粒子(淀粉)分离。检验NaCl就是检验Na+或Cl-,据此要注意不能用盐酸溶解蛋壳,最终设计相应的方案检验Cl-。
①步骤a中溶解蛋壳(主要成分为CaCO3),盐酸、硫酸和醋酸都可以与碳酸盐反应,但结合题意设计,要检验溶液中的Cl-,不能引入Cl-,故不能使用盐酸,硫酸与碳酸钙反应生成微溶物硫酸钙,也会影响实验效果,不适用硫酸,醋酸与碳酸钙反应生成的醋酸钙可溶,形成的半透膜进行实验效果最好,故溶解鸡蛋壳最好使用醋酸,答案为:醋酸;
②检验烧杯中有无淀粉,可利用淀粉的特性,淀粉遇碘变蓝,则操作为取少量烧杯中液体,加入碘水看是否变为蓝色;检验烧杯中有无NaCl,可利用氯离子的检验方法,操作是另取少量烧杯中液体,加入几滴硝酸银溶液,若有白色沉淀生成,则证明烧杯溶液中含有氯离子;
③要获得较纯净的淀粉溶液需要多次操作,即反复水洗,所以正确的操作为:多次进行渗析操作,每次用水量不必太多;或者将蛋膜放在有流水的水槽中进行渗析操作,故答案选BC;
④检验氯化钠的存在,检验氯离子即可,用硝酸银和稀硝酸检验氯离子,即加入硝酸银溶液,若无沉淀产生,证明没有氯离子,即氯化钠已全部去除。

 走进文言文系列答案
走进文言文系列答案【题目】已知:Fe2+遇铁氰化钾(K3[Fe(CN)6])会产生特征的蓝色沉淀;AgI是难溶于水的黄色固体。将0.2mol·L-1的KI溶液和0.05mol·L-1Fe2(SO4)3溶液等体积混合后,取混合液分别完成上述实验,能说明溶液中存在化学平衡“2Fe3++2I-![]() 2Fe2++I2”的是( )
2Fe2++I2”的是( )
编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 生成黄色沉淀 |
③ | 滴入K3[Fe(CN)6]溶液 | 生成蓝色沉淀 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A.①B.②和④C.③和④D.③