题目内容
已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量 ②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量 ③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量。下列叙述正确的是 ( )。
| A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)===2HCl(g) |
| B.氢气和氯气反应生成2 mol氯化氢气体,反应的ΔH=+183 kJ·mol-1 |
| C.氢气和氯气反应生成2 mol氯化氢气体,反应的ΔH=-183 kJ·mol-1 |
| D.氢气和氯气反应生成1 mol氯化氢气体,反应的ΔH=+183 kJ·mol-1 |
C
解析

练习册系列答案
相关题目
以下变化后物质的总能量升高的是
| A.钢铁生锈 | B.气态SO3变成固态三聚物 |
| C.水电解 | D.1,3-环己二烯生成苯 |
下列热化学方程式书写正确的是(ΔH的绝对值均正确) ( )
| A.C(s)+1/2O2(g)=CO(g) ΔH=-110.5kJ·mol-1 (燃烧热) |
| B.2H2O(g)=2H2(g)+O2(g) ΔH=+483.6 kJ·mol-1(反应热) |
| C.C2H5OH+3O2=2CO2+3H2O ΔH=-1368.8 kJ·mol-1(反应热) |
| D.2NaOH(aq)+H2SO4(aq)=Na2SO4 (aq)+2H2O(l) ΔH=-114.6 kJ·mol-1(中和热) |
下列依据热化学方程式得出的结论正确的是
| A.已知C(石墨, s)=C(金刚石, s) ΔH>0,则金刚石比石墨稳定 |
| B.已知C(s)+O2(g)=CO2(g) ΔH1;C(s)+1/2O2(g)=CO(g) ΔH2,则ΔH2>ΔH1 |
| C.已知2H2(g)+O2(g)=2H2O(g) ΔH=" -483.6" kJ/mol,则氢气的燃烧热为241.8kJ/mol |
| D.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3kJ/mol,则含20gNaOH的稀溶液与稀盐酸完全中和,中和热为28.65kJ/mol |
工业上采用NH3作还原剂脱氮原理为:
NO(g)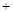 NO2(g)
NO2(g)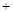 2NH3(g)
2NH3(g)  2N2(g)
2N2(g)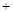 3H2O(g),
3H2O(g),
烟气以一定的流速通过,测量不同温度下逸出气体中氮氧化物含量,从而确定烟气效率,右图是两种不同催化剂的脱氮效率曲线,判断以下分析正确的是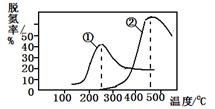
| A.上述反应的正反应为吸热反应 |
| B.催化剂①、②分别适合于250℃和450 ℃左右脱氮 |
| C.曲线①、②最高点表示此时平衡转化率最高 |
| D.相同条件下,改变压强对脱氮率没有影响 |
实验室中制备乙烯的方法是使乙醇脱水,反应可以简单地表示为CH3CH2OH―→CH2=CH2↑+H2O。已知CH2=CH2(g)和C2H5OH(l)的燃烧热分别是1 411.0 kJ·mol-1和1 366.8 kJ·mol-1。则实验室用C2H5OH(l)制备CH2=CH2(g)生成1 mol液态水的ΔH为( )
| A.-44.2 kJ·mol-1 |
| B.+44.2 kJ·mol-1 |
| C.-2 777.8 kJ·mol-1 |
| D.+2 777.8 kJ·mol-1 |
“低碳经济”是以低能耗、低污染、低排放为基础的可持续发展的经济模式。下列说法与“低碳经济”不符合的是 ( )。
| A.采用压缩天然气代替燃油 |
| B.加快化石燃料的开采与使用,提高人们的生活水平 |
| C.利用硅材料制成光伏发电装置发电 |
| D.利用太阳能、风能等,减少化石燃料的使用 |
已知:NH3·H2O(aq)与H2SO4(aq)反应生成1 mol正盐的ΔH=
-24.2 kJ·mol-1;强酸、强碱的稀溶液反应的中和热ΔH=-57.3 kJ·mol-1。则NH3·H2O在水溶液中电离的ΔH等于( )
| A.-69.4 kJ·mol-1 | B.-45.2 kJ·mol-1 |
| C.+69.4 kJ·mol-1 | D.+45.2 kJ·mol-1 |
 2B(g);若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则该反应的△H =(Ea-Eb)kJ·mol-1。其归纳正确的是 ( )
2B(g);若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则该反应的△H =(Ea-Eb)kJ·mol-1。其归纳正确的是 ( )