题目内容
下列反应中生成物的总能量大于反应物总能量的非氧化还原反应是
| A.铝热反应 | B.氯化铝溶液的水解 |
| C.氢氧化钠和盐酸反应 | D.焦炭在高温下与水蒸气反应 |
B
解析试题分析:生成物的总能量大于反应物总能量,说明反应是吸热反应。A、铝热反应是放热反应,也是氧化还原反应,A不正确;B、氯化铝的水解是吸热反应,且不是氧化还原反应,B正确;C、酯化反应是非氧化还原反应,但属于放热反应,C不正确;D、焦炭在高温下与水蒸气反应生成氢气和CO属于吸热反应,但属于氧化还原反应,D不正确,答案选B。
考点:考查放热反应、吸热反应以及氧化还原反应的判断

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案下列热化学方程式书写正确的是(ΔH的绝对值均正确) ( )
| A.C(s)+1/2O2(g)=CO(g) ΔH=-110.5kJ·mol-1 (燃烧热) |
| B.2H2O(g)=2H2(g)+O2(g) ΔH=+483.6 kJ·mol-1(反应热) |
| C.C2H5OH+3O2=2CO2+3H2O ΔH=-1368.8 kJ·mol-1(反应热) |
| D.2NaOH(aq)+H2SO4(aq)=Na2SO4 (aq)+2H2O(l) ΔH=-114.6 kJ·mol-1(中和热) |
下列依据热化学方程式得出的结论正确的是
| A.已知C(石墨, s)=C(金刚石, s) ΔH>0,则金刚石比石墨稳定 |
| B.已知C(s)+O2(g)=CO2(g) ΔH1;C(s)+1/2O2(g)=CO(g) ΔH2,则ΔH2>ΔH1 |
| C.已知2H2(g)+O2(g)=2H2O(g) ΔH=" -483.6" kJ/mol,则氢气的燃烧热为241.8kJ/mol |
| D.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3kJ/mol,则含20gNaOH的稀溶液与稀盐酸完全中和,中和热为28.65kJ/mol |
已知下列热化学方程式:
2Zn(s)+O2(g) = 2ZnO(s) ΔH=-702.2 kJ·mol-1
Hg(l)+1/2O2(g) = HgO(s) ΔH=-90.7 kJ·mol-1
由此可知Zn(s)+HgO(s) = ZnO(s)+Hg(l)的反应热ΔH为( )
| A.-260.4 kJ·mol-1 | B.+260.4 kJ·mol-1 |
| C.-611.5 kJ·mol-1 | D.+520.8 kJ·mol-1 |
某反应能量变化如右下图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列叙述正确的是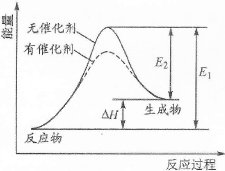
| A.该反应为放热反应 |
| B.催化剂能改变反应的焓变 |
| C.催化剂能降低反应的活化能 |
| D.逆反应的活化能大于正反应的活化能 |
碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示:
①H2(g) + I2(?) 2HI(g)+9.48kJ
2HI(g)+9.48kJ
②H2(g) + I2(?) 2HI(g)-26.48kJ
2HI(g)-26.48kJ
下列判断正确的是
| A.①中的I2为固态,②中的I2为气态 |
| B.②的反应物总能量比①的反应物总能量低 |
| C.①的产物比反应②的产物热稳定性更好 |
| D.1mol 固态碘升华时将吸热17kJ |
工业上采用NH3作还原剂脱氮原理为:
NO(g)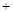 NO2(g)
NO2(g)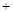 2NH3(g)
2NH3(g)  2N2(g)
2N2(g)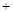 3H2O(g),
3H2O(g),
烟气以一定的流速通过,测量不同温度下逸出气体中氮氧化物含量,从而确定烟气效率,右图是两种不同催化剂的脱氮效率曲线,判断以下分析正确的是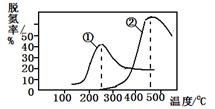
| A.上述反应的正反应为吸热反应 |
| B.催化剂①、②分别适合于250℃和450 ℃左右脱氮 |
| C.曲线①、②最高点表示此时平衡转化率最高 |
| D.相同条件下,改变压强对脱氮率没有影响 |
能够表示燃烧热的是( )
| A.2H2(g)+O2(g)=2H2O(g);△H1 |
| B.S(g)+O2(g)= SO2 (g);△H1 |
C.C(s)+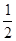 O2(g)= CO(g);△H1 O2(g)= CO(g);△H1 |
| D.H2(g)+Cl2(g) = 2HCl(g);△H1 |
“低碳经济”是以低能耗、低污染、低排放为基础的可持续发展的经济模式。下列说法与“低碳经济”不符合的是 ( )。
| A.采用压缩天然气代替燃油 |
| B.加快化石燃料的开采与使用,提高人们的生活水平 |
| C.利用硅材料制成光伏发电装置发电 |
| D.利用太阳能、风能等,减少化石燃料的使用 |