题目内容
碱金属与O2反应生成的氧化物比较复杂:有普通氧化物,如Na2O;过氧化物,如Na2O2;超氧化物,如KO2;臭氧化物,如RbO3。其中后三种均可与水或CO2反应生成氧气。要制备普通氧化物,一般要用碱金属单质还原对应的过氧化物、硝酸盐或亚硝酸盐。
(1)用化学反应方程式表示①钠与Na2O2反应__________________________。②钾与硝酸钾反应:_____________________。③RbO3与CO2反应:______________________________。
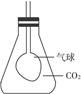
(2)若用锥形瓶收集一瓶CO2气体,在瓶内有一只扎紧在玻璃管末端的气球,如下图。打开塞子迅速往瓶里加入一种物质后,立即塞紧塞子,一段时间后气球就会自动膨胀,该物质可能是
(1)用化学反应方程式表示①钠与Na2O2反应__________________________。②钾与硝酸钾反应:_____________________。③RbO3与CO2反应:______________________________。

(2)若用锥形瓶收集一瓶CO2气体,在瓶内有一只扎紧在玻璃管末端的气球,如下图。打开塞子迅速往瓶里加入一种物质后,立即塞紧塞子,一段时间后气球就会自动膨胀,该物质可能是
| A.Na2O | B.Na2O2 | C.KO2 | D.RbO3 |
(1)①2Na+Na2O2====2Na2O ②10K+2KNO3====6K2O+N2↑
③4RbO3+2CO2====2Rb2CO3+5O2
(2)AB
③4RbO3+2CO2====2Rb2CO3+5O2
(2)AB
(1)①钠具有还原性,Na2O2具有氧化性,二者可发生如下反应:
2Na+Na2O2====2Na2O
②同理根据题设,钾与硝酸钾反应时生成单质,则反应为10K+2KNO3====6K2O+N2↑。注意,此反应的最终产物为K2O而不是K2O2,因为K2O2能与K反应生成K2O。
③类比过氧化钠与二氧化碳反应,可得4RbO3+2CO2====2Rb2CO3+5O2。
(2)气球会膨胀,表明瓶内气体压强减小(即气体总体积减小),答案为A、B。
2Na+Na2O2====2Na2O
②同理根据题设,钾与硝酸钾反应时生成单质,则反应为10K+2KNO3====6K2O+N2↑。注意,此反应的最终产物为K2O而不是K2O2,因为K2O2能与K反应生成K2O。
③类比过氧化钠与二氧化碳反应,可得4RbO3+2CO2====2Rb2CO3+5O2。
(2)气球会膨胀,表明瓶内气体压强减小(即气体总体积减小),答案为A、B。

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案
相关题目