题目内容
在0 ℃、101 kPa时进行下列实验:甲、乙、丙各取30.0 mL同浓度的盐酸,加入同一镁铝合金粉末产生气体,有关数据列表如下:
(1)盐酸的物质的量浓度为____________。
(2)合金中镁的质量分数为____________,铝的质量分数为____________。
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 510 | 765 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
(2)合金中镁的质量分数为____________,铝的质量分数为____________。
(1)2.00 mol·L-1 (2)47.1% 52.9%
此题考查镁、铝单质的化学性质。
(1)由表中数据可推知乙、丙实验中盐酸不足。
n(HCl)=2n(H2)=2×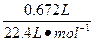 ="0.060 " 0 mol
="0.060 " 0 mol
所以,n(HCl)=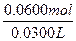 ="2.00" mol·L-1。
="2.00" mol·L-1。
(2)由表可知甲实验中盐酸过量,镁、铝合金不足。
设甲中Mg、Al的物质的量分别为x、y,
Mg — 2HCl
x 2x
Al — 3HCl
y 3y
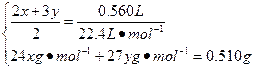
解得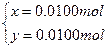
所以,合金中镁的质量分数为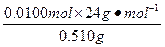 ×100%=47.1%,
×100%=47.1%,
铝的质量分数为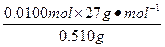 ×100%=52.9%。
×100%=52.9%。
(1)由表中数据可推知乙、丙实验中盐酸不足。
n(HCl)=2n(H2)=2×
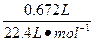 ="0.060 " 0 mol
="0.060 " 0 mol所以,n(HCl)=
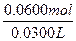 ="2.00" mol·L-1。
="2.00" mol·L-1。(2)由表可知甲实验中盐酸过量,镁、铝合金不足。
设甲中Mg、Al的物质的量分别为x、y,
Mg — 2HCl
x 2x
Al — 3HCl
y 3y
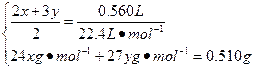
解得
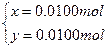
所以,合金中镁的质量分数为
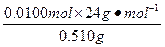 ×100%=47.1%,
×100%=47.1%,铝的质量分数为
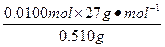 ×100%=52.9%。
×100%=52.9%。
练习册系列答案
相关题目
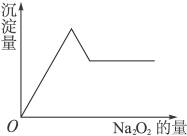
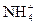 、Mg2+和Cu2+等离子中的一种或几种。现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀。如加入Na2O2的量与生成白色沉淀的量之间的关系用右图来表示。试推断:
、Mg2+和Cu2+等离子中的一种或几种。现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀。如加入Na2O2的量与生成白色沉淀的量之间的关系用右图来表示。试推断: