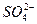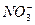题目内容
(8分)向由铝粉和过氧化钠组成的混合物中加入足量水,当反应停止后,溶液澄清,共收集到3.5 g气体,向所得澄清溶液中滴加200 mL 3.5 mol·L-1的盐酸,溶液先澄清,然后出现白色沉淀,最后沉淀恰好溶解。求原混合物中铝和过氧化钠各多少克。
m(Al)="2.7" g m(Na2O2)="15.6" g
根据题意,Na2O2与水反应产生NaOH和O2,生成的NaOH和Al反应生成NaAlO2和H2,根据题给信息,反应停止后,溶液澄清,说明NaOH溶液足量,Al完全反应,加盐酸至沉淀刚好完全溶解,溶液中溶质为AlCl3和NaCl。
设铝粉质量为x,Na2O2质量为y,根据原子守恒,列出等量关系式求解。
2Al~3H2~2AlCl3~6HCl 2Na2O2~O2~4NaCl~4HCl
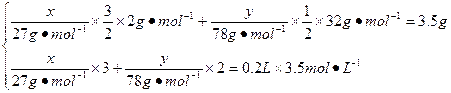
解得x="2.7" g y="15.6" g
即m(Al)="2.7" g m(Na2O2)="15.6" g
设铝粉质量为x,Na2O2质量为y,根据原子守恒,列出等量关系式求解。
2Al~3H2~2AlCl3~6HCl 2Na2O2~O2~4NaCl~4HCl
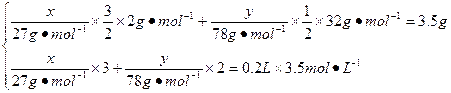
解得x="2.7" g y="15.6" g
即m(Al)="2.7" g m(Na2O2)="15.6" g

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目
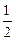 Al2O3(s)+
Al2O3(s)+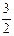 H2O(g); △H2=+87.7kJ·mol-1
H2O(g); △H2=+87.7kJ·mol-1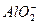 、Na+、
、Na+、