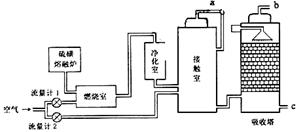
题目内容
工业上制硫酸的设备分为三大部分,一是沸腾炉、二是接触室、三是吸收塔。在沸腾炉内煅烧黄铁矿生成二氧化硫;在接触室内有催化剂存在下二氧化硫进一步与氧气结合,生成三氧化硫;三氧化硫流经吸收塔时,采用98.3%的浓硫酸吸收,使三氧化硫最终与水化合形成硫酸。
下面的装置是仿照工业上制备硫酸的工艺流程设计出来的,用于探究工业上为何采
用98.3%的浓硫酸吸收三氧化硫。
请回答下列问题:
(1)写出沸腾炉内煅烧黄铁矿的反应方程式:____________________________________;
(2)上图中的乙、丙分别相当于工业上制取硫酸装置中的:_______________、_______________;
(3)丙中的现象为_________________________、丁中的现象为_______________________。
(4)下图是压强对SO2平衡转化率的影响
对SO2转化为SO3的反应,增大压强可使转化率________________,只所以通常采用常压操作是因为:____________________。
(1)4FeS2 +11O2 = 2Fe2O3 + 8SO2(2分)
(2)接触室 吸收塔 (各1分)
(3)无酸雾 有酸雾 (各1分)
(4)增大 常压下SO2的转化率已经很大 (各1分)
解析试题分析:(1)黄铁矿的主要成分为FeS2,被氧气氧化为Fe2O3和SO2。
(2)黄铁矿的煅烧在接触室内进行,SO3的吸收在吸收塔内进行。
(3)用浓H2SO4吸收SO3,无酸雾 ;用水吸收SO3会产生酸雾。
(4)增大压强使平衡向右移动,转化率增大;但是在常压下SO2的转化率已经很大,所以采用常压操作。
考点:本题考查化学方程式的书写、工业制取硫酸装置、反应现象、化学平衡。

I.目前,我国采用“接触法”制硫酸,设备如图所示:
(1)图中设备A的名称是_____________,该设备中主要反应的化学方程式为 。
(2)有关接触法制硫酸的下列说法中,不正确的是_____(填字母序号)。
| A.二氧化硫的接触氧化在接触室中发生 |
| B.吸收塔用浓度为98.3%浓硫酸吸收三氧化硫 |
| C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失2% |
| D.B装置中反应的条件之一为较高温度是为了提高SO2的转化率 |
II.纯碱是一种重要的化工原料。制碱工业主要有“氨碱法”(索尔维法)和“联合制碱法”(侯氏制碱法)两种工艺。请按要求回答问题:
(3)CO2是制碱工业的重要原料,“联合制碱法”中CO2的来源于 ,“氨碱法”中CO2来源于 。
(4)氨碱法的原子利用率(原子利用率=期望产物的总质量与生成物的总质量之比) 。
(5)写出“联合制碱法”有关反应的化学方程式: 。
硫酸工业在国民经济中占有极其重要的地位。
(1)硫酸的最大消费渠道是化肥工业,用硫酸制造的常见化肥有________(任写一种)。
(2)硫酸生产中,根据化学平衡原理来确定的条件或措施有________(填写序号)。
| A.矿石加入沸腾炉之前先粉碎 |
| B.使用V2O5作催化剂 |
| C.转化器中使用适宜的温度 |
| D.净化后的炉气中要有过量的空气 |
F.吸收塔中用98.3%的浓硫酸吸收SO3
(3)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:2SO2(g)+
 O2(g)
O2(g) 2SO3(g) ΔH=-98.3 kJ·mol-1。在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为________。
2SO3(g) ΔH=-98.3 kJ·mol-1。在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为________。(4)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化器、吸收塔)。
①三个设备分别使反应物之间或冷热气体之间进行“对流”。请简单描述吸收塔中反应物之间是怎样对流的。______________________________。
②工业生产中常用氨-酸法进行尾气脱硫,以达到消除污染、废物利用的目的。用化学方程式表示其反应原理。(只写出2个方程式即可)
________________________________________________________________________
为解决日益加剧的温室效应等问题,科学家正在研究建立如下图所示的二氧化碳新循环体系:
上述关系图能反映的化学观点或化学思想有:( )
①化学变化中元素种类是守恒的;②燃烧时化学能可以转化为热能和光能;③光能或电能可以转化为化学能;④无机物和有机物可以相互转化;⑤二氧化碳也是一种重要的资源.
| A.①②③ | B.①②④⑤ | C.①④⑤ | D.①②③④⑤ |
草木灰中含有碳酸钾,它属于( )。
| A.氮肥 | B.钾肥 | C.复合肥料 | D.微量元素肥料 |