题目内容
纯碱和硫酸都是重要的化工原料,用途非常广泛。
(1)利用氨碱法得到的碳酸氢钠经煅烧生成纯碱。工艺流程如下图所示:
氨碱法示意图
图中的中间产物C是_________,D是________(写化学式);装置乙中发生反应的化学方程式为_________________________________。
(2)火山喷发所产生的硫磺可用于生产重要的化工原料硫酸。甲企业用接触法生产硫酸采用的主要原料是硫磺和空气。工艺流程如下图所示: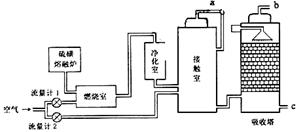
为了充分利用反应放出的热量,接触室中应安装____________(填设备名称)。吸收塔中填充许多瓷管,其作用是____________。为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%。为提高SO2的转化率,经流量计2的氧气量为接触室中SO2完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为____________。
(8分)
(1)Ca(OH)2(1分);NH3(1分);
NH3+CO2+H2O+NaCl= NaHCO3↓+ NH4Cl(2分)
(2)热交换器(1分);增加SO3与浓硫酸的接触面积,有利于SO3的吸收(1分);
6:5(2分)
解析试题分析:
(1)结合题中信息可以得出C为石灰窑的产物CaO与H2O的生成物Ca(OH)2;D为Ca(OH)2和NH4Cl反应的产物NH3;装置乙中发生的为侯氏制碱法主要反应反应NH3+CO2+H2O+NaCl= NaHCO3↓+ NH4Cl。
(2)为了充分利用反应放出的热量,接触室中应安装热交换器;填充许多瓷管,其作用是增加SO3与浓硫酸的接触面积;设有1molS反应,根据方程式S+O2=SO2,需要1molO2,生成1molSO2,为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%,需要1.5molO2, 1molSO2在接触室中SO2完全氧化时理论需氧量为0.5mol,经流量计2的氧气量为接触室中SO2完全氧化时理论需氧量的2.5倍即1.25mol。生产过程中流经流量计1和流量计2的空气体积比应为1.5mol: 1.25mol=6:5
考点:本题以化学工艺流程为基础,考查了元素及化合物性质、氧化还原反应计算,结合图像的化学计算。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案化学工业是国民经济的支柱产业.下列生产过程中不涉及化学变化的是
| A.氮肥厂用氢气和氮气合成氨 | B.钢铁厂用热还原法冶炼铁 |
| C.硫酸厂用接触法生产硫酸 | D.炼油厂用分馏法生产汽油 |
小明家责任田里的庄稼生长不茂盛,叶色淡绿、茎叶细小,同时还出现了不同程度的倒伏现象。请问:
(1)小明家的庄稼缺两种营养元素,它们是________(填“N”“P”“K”或“微量元素”)。
(2)某生产资料公司的化肥价格如下表:
| 化肥 | 尿素CO(NH2)2 | 碳铵NH4HCO3 | 磷矿粉Ca3(PO4)2 |
| 价格(元/吨) | 1 200 | 350 | 150 |
| 化肥 | 过磷酸钙Ca(H2PO4)2 | 氯化钾 | 硫酸钾 |
| 价格(元/吨) | 250 | 650 | 800 |
在考虑既经济实用又解决问题的条件下,你认为小明应购买的化肥是_____________(填化学式)。
“碳捕捉和储存(CCS)”技术是指通过碳捕捉技术,将工业和有关能源产业所产生的二氧化碳分离出来再利用。当前,二氧化碳及其产品的开发、应用是很多科学家致力研究的课题。下列有关说法不正确的是( )
| A.人类应将大气中的二氧化碳全部捕捉,以防产生温室效应 |
| B.对捕捉到的二氧化碳进行净化,然后用于制造干冰 |
| C.以捕捉到的二氧化碳为原料,用来制备甲醇等产品 |
| D.用捕捉到的二氧化碳与海藻发生光合作用,可提高海藻产量 |



 ,可选择下列溶液中的 (填字母序号),并将加入的顺序以箭头符号(↓)的形式画在图上(精制过程中加入试剂从左到右的顺序为先后顺序)。
,可选择下列溶液中的 (填字母序号),并将加入的顺序以箭头符号(↓)的形式画在图上(精制过程中加入试剂从左到右的顺序为先后顺序)。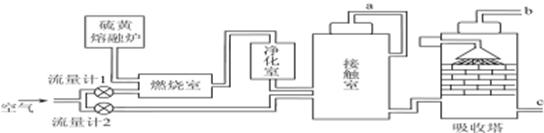
 2MgCl2(aq) +SiO2 (s) + 2H2O(l) △H =-49.04 kJ·mol-1
2MgCl2(aq) +SiO2 (s) + 2H2O(l) △H =-49.04 kJ·mol-1
