题目内容
过碳酸钠(SPC)俗称固体双氧水,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中,生产过碳酸钠的主要流程如下:
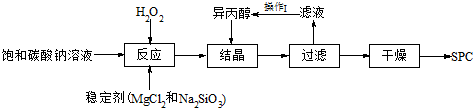
(1)反应的最佳温度控制在15℃~20℃,温度偏高时造成产率低的可能原因有
(2)操作Ⅰ的名称为
(3)加入异丙醇的作用是
(4)过碳酸钠的化学式可表示为aNa2CO3?bH2O2.现将一定质量的过碳酸钠粉末配成稀溶液,再向其中加入适量MnO2粉末,完全反应后生成672mL气体(标准状况).反应后的混合物经过滤、洗涤后,将滤液和洗涤液混合并加水配成100mL溶液A.现向体积为10mL、浓度为cmol?L-1的稀硫酸中逐滴滴入溶液A,边滴边振荡,充分反应后,测得实验数据如下表所示:
通过计算确定过碳酸钠的化学式.

(1)反应的最佳温度控制在15℃~20℃,温度偏高时造成产率低的可能原因有
双氧水分解
双氧水分解
.(2)操作Ⅰ的名称为
蒸馏
蒸馏
.(3)加入异丙醇的作用是
降低过碳酸钠的溶解度
降低过碳酸钠的溶解度
.(4)过碳酸钠的化学式可表示为aNa2CO3?bH2O2.现将一定质量的过碳酸钠粉末配成稀溶液,再向其中加入适量MnO2粉末,完全反应后生成672mL气体(标准状况).反应后的混合物经过滤、洗涤后,将滤液和洗涤液混合并加水配成100mL溶液A.现向体积为10mL、浓度为cmol?L-1的稀硫酸中逐滴滴入溶液A,边滴边振荡,充分反应后,测得实验数据如下表所示:
| 实验序号 | Ⅰ | Ⅱ | Ⅲ | IV |
| 滴加溶液A的体积/mL | 5.0 | 10.0 | 15.0 | 20.0 |
| 生成气体的体积/mL(标准状况) | 44.8 | 89.6 | 89.6 | 89.6 |
2Na2CO3?3H2O2
2Na2CO3?3H2O2
.分析:(1)温度偏高时双氧水分解;
(2)分离互溶的液体采用蒸馏的方法;
(3)过碳酸钠在异丙醇中溶解度小于在水中的溶解度;
(4)双氧水分解生成水和氧气,根据氧气的量计算双氧水的量;根据表格知,10mL、浓度为cmol?L-1的稀硫酸恰好能与10mLA溶液反应,根据二氧化碳的体积计算碳酸钠的物质的量,从而确定过碳酸钠的化学式.
(2)分离互溶的液体采用蒸馏的方法;
(3)过碳酸钠在异丙醇中溶解度小于在水中的溶解度;
(4)双氧水分解生成水和氧气,根据氧气的量计算双氧水的量;根据表格知,10mL、浓度为cmol?L-1的稀硫酸恰好能与10mLA溶液反应,根据二氧化碳的体积计算碳酸钠的物质的量,从而确定过碳酸钠的化学式.
解答:解:(1)双氧水不稳定,则温度偏高时分解生成水和氧气导致产率低,所以反应的最佳温度控制在15℃~20℃,
故答案为:双氧水分解;
(2)分离互溶的液体采用蒸馏的方法,异丙醇和水能互溶,则操作Ⅰ的名称蒸馏,故答案为:蒸馏;
(3)根据相似相溶原理知,过碳酸钠在异丙醇中溶解度小于在水中的溶解度,所以向反应液中加入异丙醇是降低过碳酸钠的溶解度,故答案为:降低过碳酸钠的溶解度;
(4)双氧水分解生成水和氧气,根据氧气的量知双氧水的物质的量=
×2=0.06mol;
根据表格知,10mL、浓度为cmol?L-1的稀硫酸恰好能与10mLA溶液反应,根据二氧化碳的体积知碳酸钠的物质的量=
=0.004mol,则100mLA溶液中碳酸钠的物质的量为0.04mol,则碳酸钠和双氧水的个数比=0.04mol:0.06mol=2:3,所以其化学式为:2Na2CO3?3H2O2,
答:2Na2CO3?3H2O2.
故答案为:双氧水分解;
(2)分离互溶的液体采用蒸馏的方法,异丙醇和水能互溶,则操作Ⅰ的名称蒸馏,故答案为:蒸馏;
(3)根据相似相溶原理知,过碳酸钠在异丙醇中溶解度小于在水中的溶解度,所以向反应液中加入异丙醇是降低过碳酸钠的溶解度,故答案为:降低过碳酸钠的溶解度;
(4)双氧水分解生成水和氧气,根据氧气的量知双氧水的物质的量=
| 0.672L |
| 22.4L/mol |
根据表格知,10mL、浓度为cmol?L-1的稀硫酸恰好能与10mLA溶液反应,根据二氧化碳的体积知碳酸钠的物质的量=
| 0.0896L |
| 22.4L/mol |
答:2Na2CO3?3H2O2.
点评:本题考查了物质的分离和提纯、化学式的确定,难度较大,难点是过碳酸钠化学式的确定.

练习册系列答案
相关题目