题目内容
4.五种短周期元素,它们在周期表中的位置如图1所示,回答下列问题(1)若它们均属于主族元素,则A的基态原子电子排布图为
 ,五种元素中,电负性最大的元素是F,能形成强含氧酸的元素是N、S,第I电离能最小的是Al.
,五种元素中,电负性最大的元素是F,能形成强含氧酸的元素是N、S,第I电离能最小的是Al.(2)若五种元素均为p区元素且有如图2转化关系.图2中Y是难溶性固体、Z是E的最高价氧化物对应的水化物.
①若Y+Z不反应,则C的元素符号是Ne;D+NaOH反应的离子方程式为Si+2OH-+H2O=SiO32-+2H2↑.
②若Y能溶于Z中,则E的价层电子排布式为3s23p4,X溶液与过量CO2反应的离子方程式为CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓.

分析 A、B、C、D、E五种短周期元素,
(1)若它们均属于主族元素,则根据各元素在周期表的位置可推断A为C,B为N,C为F,D为Al,E为S,根据元素周期律答题;
(2)若五种元素均为p区元素且有如图2转化关系,D单质与氢氧化钠溶液反应生成气体,则D为铝或硅,Y是难溶性固体、Z是E的最高价氧化物对应的水化物,
①若Y+Z不反应,则D为Si,Y为H2SiO3,E为Cl,C为Ne,②若Y能溶于Z中,则D为Al,X为NaAlO2,Y为Al(OH)3,据此答题.
解答 解:A、B、C、D、E五种短周期元素,
(1)若它们均属于主族元素,则根据各元素在周期表的位置可推断A为C,B为N,C为F,D为Al,E为S,A的基态原子电子排布图为 ,元素的非金属性越强,元素的电负性越强,五种元素中,非金属性最强的是F,所以电负性最大的元素是F,能形成强含氧酸的元素是N、S,分别形成硝酸和硫酸,金属性最强的,第I电离能最小,所以第I电离能最小的是Al,
,元素的非金属性越强,元素的电负性越强,五种元素中,非金属性最强的是F,所以电负性最大的元素是F,能形成强含氧酸的元素是N、S,分别形成硝酸和硫酸,金属性最强的,第I电离能最小,所以第I电离能最小的是Al,
故答案为: ;F;N、S;Al;
;F;N、S;Al;
(2)若五种元素均为p区元素且有如图2转化关系,D单质与氢氧化钠溶液反应生成气体,则D为铝或硅,Y是难溶性固体、Z是E的最高价氧化物对应的水化物,
①若Y+Z不反应,则D为Si,Y为H2SiO3,E为Cl,C为Ne,D+NaOH反应的离子方程式为,
故答案为:Ne;Si+2OH-+H2O=SiO32-+2H2↑;
②若Y能溶于Z中,则D为Al,所以A为C,B为N,C为F,E为S,X为NaAlO2,Y为Al(OH)3,E的价层电子排布式为3s23p4,X溶液与过量CO2反应的离子方程式为CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,
故答案为:3s23p4;CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓.
点评 本题考查位置、结构、性质的关系及应用,元素推断是解答本题的关键,学生应学会利用位置及相关物质的性质确定元素种类,并熟悉物质的性质来解答即可.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案| A. | Na2CO3溶液,浓H2SO4,品红溶液 | B. | 品红溶液,Na2CO3溶液,浓H2SO4 | ||
| C. | 小苏打溶液,无水氯化钙 | D. | 酸性KMnO4溶液,碱石灰 |
| A. | 一个N≡N断裂的同时,有3个H-H键断裂 | |
| B. | 保持其它条件不变时,体系压强不再改变 | |
| C. | 恒温恒容时,密度保持不变 | |
| D. | 正反应速率v(H2)=0.6mol/L•min,逆反应速率v(NH3)=0.4mol/L•min |
| A. | 人体中的糖类、油脂和蛋白质都能为人的生命活动提供能量 | |
| B. | 淀粉和纤维素$\stackrel{水解}{→}$葡萄糖$\stackrel{氧化}{→}$CO2和H2O(释放能量维持生命活动) | |
| C. | 油脂$\stackrel{水解}{→}$甘油和高级脂肪酸$\stackrel{氧化}{→}$CO2和H2O(释放能量维持生命活动) | |
| D. | 蛋白质$\stackrel{水解}{→}$氨基酸$\stackrel{合成}{→}$人体所需的蛋白质(人体生长发育、新陈代谢) |
①取少量淀粉加水制成溶液
②加热
③加入Cu(OH)2悬浊液
④加入几滴稀硫酸
⑤加入NaOH溶液,调pH至碱性.
| A. | ①②⑤③② | B. | ①②④⑤③ | C. | ①④②③ | D. | ①④②⑤③② |
| A. | 3c-a-b | B. | a+b-3c | C. | a+3b-2c | D. | a+3b-6c |
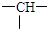 ,它可能的结构数目是( )
,它可能的结构数目是( ) 某有机物A的化学式为C5H10O2,己知A~E有如图转化关系,且D不与Na2CO3溶液反应,C、E均不能发生银镜反应,则A的结构可能有( )
某有机物A的化学式为C5H10O2,己知A~E有如图转化关系,且D不与Na2CO3溶液反应,C、E均不能发生银镜反应,则A的结构可能有( )