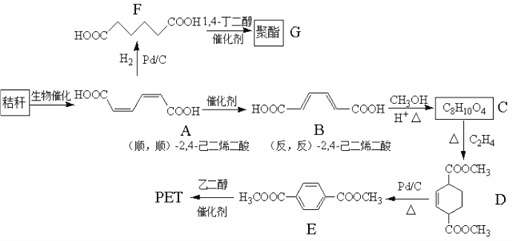
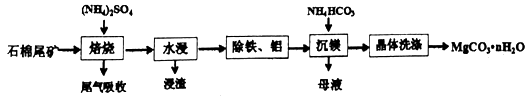
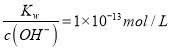题目内容
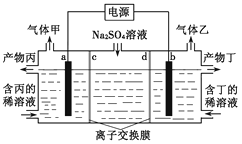
【题目】1LMgSO4和CuSO4的混合液中c(SO42-)= 2mol/L,用石墨电极电解此溶液,通电一段时间,两极上均产生22.4L(标准状况)气体,则原混合液中Mg2+的浓度是( )
A. 0.5mol/L B. 1mol/L C. 1.5mol/L D. 2mol/L
【答案】B
【解析】n(气体)=![]() =1mol。阳极电极反应式为:4OH--4e-=O2↑+2H2O,n(O2)=1mol,则电路中通过的电子物质的量为4mol;阴极产生气体的电极反应式为:2H++2e-=H2↑,n(H2)=1mol,生成H2得到电子物质的量为2mol;则阴极上Cu2+放电得到电子物质的量为4mol-2mol=2mol,根据Cu2++2e-=Cu,n(Cu2+)=1mol,c(Cu2+)=1mol
=1mol。阳极电极反应式为:4OH--4e-=O2↑+2H2O,n(O2)=1mol,则电路中通过的电子物质的量为4mol;阴极产生气体的电极反应式为:2H++2e-=H2↑,n(H2)=1mol,生成H2得到电子物质的量为2mol;则阴极上Cu2+放电得到电子物质的量为4mol-2mol=2mol,根据Cu2++2e-=Cu,n(Cu2+)=1mol,c(Cu2+)=1mol![]() 1L=1mol/L;根据电荷守恒:2c(Mg2+)+2c(Cu2+)=2c(SO42-),c(Mg2+)=(2mol/L
1L=1mol/L;根据电荷守恒:2c(Mg2+)+2c(Cu2+)=2c(SO42-),c(Mg2+)=(2mol/L![]() 2-1mol/L
2-1mol/L![]() 2)
2)![]() 2=1mol/L,答案选B。
2=1mol/L,答案选B。

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目