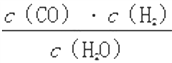题目内容
【题目】石棉尾矿主要含有Mg3(Si2O5)(OH)4和少量的Fe2O3、Al2O3 . 以石棉尾矿为供源制备碳酸镁晶须(MgCO3nH2O)的工艺如下: 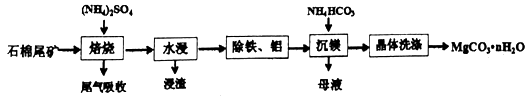
已知“焙烧”过程中的主反应为:
Mg3(Si2O5)(OH)4+5(NH4)2SO4 3Mg ![]() SO4+10NH3↑+2SiO2+7H2O↑+2SO3↑
SO4+10NH3↑+2SiO2+7H2O↑+2SO3↑
(1)写出焙烧产物NH3的电子式 .
(2)为提高水浸速率,可采取的措施为(任写一条).“浸渣”的主要成分为 .
(3)“除铁、铝”时,需将pH调至8.0左右,适宜作调节剂的是(填字母代号). a.NaOH Ca(OH)2 c.NH3H2O
(4)“沉镁”过程中反应的离子方程式为 .
(5)流程中可以循环利用的物质是(填化学式).
【答案】
(1)
(2)将焙烧渣粉碎或加热或搅拌;SiO2
(3)c
(4)Mg2++2HCO3﹣+(n﹣1)H2O=MgCO3?nH2O↓+CO2↑
(5)(NH4)2SO4
【解析】解:(1)氨气为共价化合物,电子式为:  ; 所以答案是:
; 所以答案是:  ;(2)将焙烧渣粉碎或加热或搅拌可以提高水浸速率,石棉尾矿加入硫酸铵焙烧得到MgSO4、SiO2、Fe2O3、Al2O3 , 水浸,SiO2不溶于水形成浸渣;所以答案是:将焙烧渣粉碎或加热或搅拌;SiO2;(3)“除铁、铝”时,需将pH调至8.0左右,选择不引入新杂质的试剂,故可选用NH3H2O;所以答案是:c;(4)“沉镁”过程中反应的离子方程式为:Mg2++2HCO3﹣+(n﹣1)H2O=MgCO3nH2O↓+CO2↑;所以答案是:Mg2++2HCO3﹣+(n﹣1)H2O=MgCO3nH2O↓+CO2↑;(5)沉镁过程的滤液为(NH4)2SO4 , 可循环使用;
;(2)将焙烧渣粉碎或加热或搅拌可以提高水浸速率,石棉尾矿加入硫酸铵焙烧得到MgSO4、SiO2、Fe2O3、Al2O3 , 水浸,SiO2不溶于水形成浸渣;所以答案是:将焙烧渣粉碎或加热或搅拌;SiO2;(3)“除铁、铝”时,需将pH调至8.0左右,选择不引入新杂质的试剂,故可选用NH3H2O;所以答案是:c;(4)“沉镁”过程中反应的离子方程式为:Mg2++2HCO3﹣+(n﹣1)H2O=MgCO3nH2O↓+CO2↑;所以答案是:Mg2++2HCO3﹣+(n﹣1)H2O=MgCO3nH2O↓+CO2↑;(5)沉镁过程的滤液为(NH4)2SO4 , 可循环使用;
所以答案是:(NH4)2SO4 .

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目