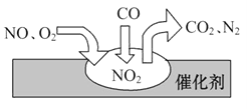
题目内容
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:
Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH1=+489.0 kJ·mol-1,
C(s) +CO2(g)=2CO(g) ΔH2=+172.5kJ·mol-1
则CO(g)还原Fe2O3(s)的热化学方程式为____。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:_____。
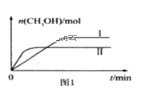
(3)将CO2和H2充入1L的密闭容器中,在两种温度下发生反应:CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g)测得CH3OH的物质的量随时间的变化见图1。
CH3OH(g) +H2O(g)测得CH3OH的物质的量随时间的变化见图1。
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ___KⅡ(填“>”或“=”或“<”)。
②一定温度下,往该容器中投入1 molCO2、3 mol H2 ,一段时间后达到平衡。若平衡后气体的压强为开始的0.8倍,则CO2的平衡转化率=____。
【答案】Fe2O3(s)+ 3CO(g)=2Fe(s)+ 3CO2(g) △H=-28.5kJ·mol-1 CO+4OH--2e-=CO32-+2H2O > 40%
【解析】
(1)①Fe2O3(s)+3C(s)=2Fe(s)+3CO(g) △H1=+489.0kJmol-1,
②C(s)+CO2(g)=2CO(g) △H2=+172.5kJmol-1,由盖斯定律①-②×3得到Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-28.5kJmol-1;
(2)CO-O2燃料电池(以KOH溶液为电解液),一氧化碳在负极失电子发生氧化反应生成二氧化碳,在氢氧化钾溶液中生成碳酸钾,负极的电极反应式为:CO+4OH--2e-=CO32-+2H2O;
(3)①根据图像可知,线Ⅱ的反应速率大于线Ⅰ,所以线Ⅱ对应的温度高于线Ⅰ,而线Ⅱ对应的甲醇的物质的量小,即升高温度,平衡逆向移动,平衡常数变小,即KⅠ>KⅡ;
②设反应的二氧化碳的物质的量为x,
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
初始(mol): 1 3 0 0
反应(mol): x 3x x x
平衡(mol):1-x 3-3x x x
平衡后气体的压强为开始时的0.8倍,同温同体积时,气体的压强之比等于物质的量之比,因此![]() =0.8,解得x=0.4mol,则CO2的平衡转化率=
=0.8,解得x=0.4mol,则CO2的平衡转化率=![]() 100%=40%。
100%=40%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】实验室以苯甲醛为原料制备间溴苯甲酸的反应如下:
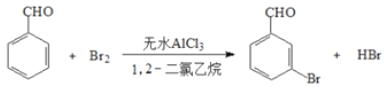
已知:(1)间溴苯甲醛温度过高时易被氧化
(2)溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点及相对分子质量见下表
物质 | 溴 | 苯甲醛 | 1,2-二氯乙烷 | 间溴苯甲醛 |
沸点/℃ | 58.8 | 179 | 83.5 | 229 |
相对分子质量 | 160 | 106 | 185 |
步骤1:将一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后装入三颈烧瓶(如下图所示)缓慢滴加经浓硫酸干燥过的足量液溴,控温反应一段时间,冷却。
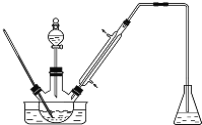
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液、有机层用10%NaHCO3溶液洗涤。
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤出MgSO4·nH2O晶体
步骤4:减压蒸馏有机层,收集相应馏分。
(1)实验装置中冷凝管的主要作用是____________,锥形瓶中应为__________(填化学式)溶液
(2)步骤1反应过程出,为提高原料利用率,适宜的温度范围内(填序号)____________
A.>299℃ B.58.8℃~179℃ C.<58.8℃
(3)步骤2中用10%NaHCO3溶液洗涤,是为了除去溶于有机层的____________(填化学式)
(4)步骤3中加入无水MgSO4固体的作用是___________________。
(5)步骤4中采用减压蒸馏,是为了防止_______________________________________。
(6)若实验中加入5.3g苯甲醛,得到3.7g间溴苯甲醛,则间溴苯甲醛产率为______________。