题目内容
17.高温及催化剂作用下,某反应的平衡常数K=$\frac{[C{O}_{2}][{H}_{2}]}{[CO][{H}_{2}O]}$.恒容时,温度升高,H2浓度减小,下列说法正确的是( )| A. | 恒温下,将容器体积变为原来2倍,CO的平衡浓度变为原来的$\frac{1}{2}$ | |
| B. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| C. | 升高温度,正反应速率减小,逆反应速率增大 | |
| D. | 该反应化学方程式为CO2+H2?CO+H2O△H<0 |
分析 某反应达平衡,平衡常数K=$\frac{[C{O}_{2}][{H}_{2}]}{[CO][{H}_{2}O]}$,反应为CO+H2O$?_{高温}^{催化剂}$CO2+H2,反应前后气体物质的量不变,恒容时,温度升高,H2浓度减小,平衡逆向进行,正反应是放热反应,据此分析.
解答 解:A、反应前后气体物质的量不变,将容器体积变为原来2倍,平衡不移动,CO的平衡浓度变为原来的$\frac{1}{2}$,故A正确;
B、恒温恒容时,如果加入氢气导致压强增大,氢气浓度增大,故B错误;
C、升温,正逆反应速率都增大,故C错误;
D、平衡常数K=$\frac{[C{O}_{2}][{H}_{2}]}{[CO][{H}_{2}O]}$,反应为CO+H2O$?_{高温}^{催化剂}$CO2+H2,故D错误;
故选A.
点评 本题考查了平衡常数的理解影响化学平衡的因素分析判断,掌握平衡移动原理和反应特征是解题的关键,题目难度中等.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
7.将Cl2通入下列溶液中,溶质不发生化学变化的是( )
| A. | Na2CO3 | B. | AgNO3 | C. | NaOH | D. | KNO3 |
6.下列关于有机化合物的说法正确的是( )
| A. |  能发生消去反应、酯化反应和加成反应 能发生消去反应、酯化反应和加成反应 | |
| B. | 硫酸铵溶液可以使蛋白质变性 | |
| C. | C4H10与C10H22一定互为同系物 | |
| D. | 分子式为C4H10O的有机物共2种 |
4.T1温度时,向密闭容器中通入N2O5,发生以下反应:2N2O5(g)?4NO3(g)+O2(g)△H>0,部分实验数据简下表下列说法中不正确的是( )
| 时间/s | 0 | 50 | 100 | 150 |
| c(N2O5)/mol.L-1 | 2.50 | 1.76 | 1.25 | 1.25 |
| A. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 | |
| B. | 50s内N2O5分解速率为1.48×10-2mol.L-1.s-1 | |
| C. | T1温度下的平衡常数为K1=15.625,平衡时N2O5的转化率为50% | |
| D. | 达到平衡后其他 条件不变,将容器的体积压缩到原来的$\frac{1}{2}$,则c(N2O5)>2.50mol.L-1 |
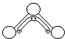 1949年度诺贝尔化学奖授予为研究臭氧做出特殊贡献的化学家.O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图所示:呈V型,键角116.5°.三个O原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键(虚线内部分)-三个O原子均等地享有这4个电子.请回答:
1949年度诺贝尔化学奖授予为研究臭氧做出特殊贡献的化学家.O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图所示:呈V型,键角116.5°.三个O原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键(虚线内部分)-三个O原子均等地享有这4个电子.请回答: )及一个氯原子,写出其结构简式并命名.
)及一个氯原子,写出其结构简式并命名.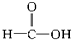 羧酸②
羧酸②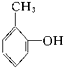 酚③
酚③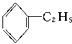 芳香烃④
芳香烃④ 羧酸⑤
羧酸⑤ 酯.
酯.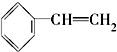 ④
④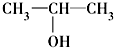 ⑤
⑤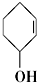 ⑥
⑥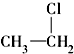 ⑦
⑦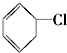 ⑧
⑧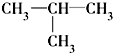 ⑨CH3-CH=CH2 (10)
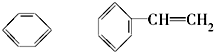
⑨CH3-CH=CH2 (10)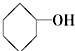 (11)
(11) ⑫CH3Cl
⑫CH3Cl
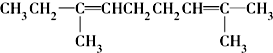 .
.