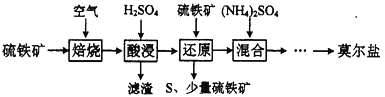
题目内容
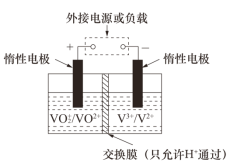
【题目】氢气是一种清洁能源。科学家探究太阳能制氢技术,设计流程图如图:
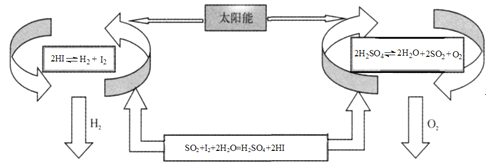
信息提示:以下反应均在150℃发生
2HI(aq)H2(g)+I2(g) △H1
SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g) △H2
2H2SO4(l)2H2O(g)+2SO2(g)+O2(g) △H3
2H2O(g)=2H2(g)+O2(g) △H4
请回答下列问题:
(1)△H4与△H1、△H2、△H3之间的关系是:△H4= ______ 。
(2)该制氢气技术的优点是 ______ ,若反应SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g)在150℃下能自发进行,则△H ______ 0(填“>”,“<”或“=”)。
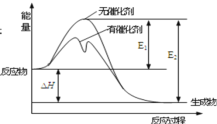
(3)在某温度下,H2SO4在不同催化剂条件下分解产生氧气的量随时间变化如图所示,则下列说法正确的是 ______。
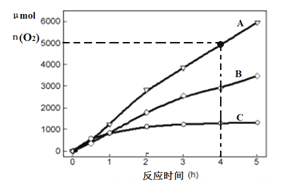
A H2SO4分解反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B 若在恒容绝热的密闭容器中发生反应,当K值不变时,说明该反应已经达到平衡
C 0~4小时在A催化剂作用下,H2SO4分解的平均速率v(O2)=1250molh-1
D 不同催化剂的催化效果不同,是因为活化分子百分数不相同
(4)对于反应:2HI(g)H2(g)+I2(g),在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数 K的计算式为: ______ 。
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为 ______ (以K和k正表示)。若k正=0.0027min-1,在t=40min时,v正= ______ min-1。
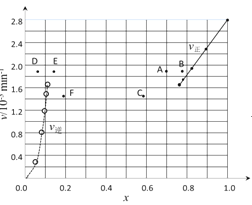
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为 ______ (填字母)。
【答案】2△H1+2△H2+△H3 物质循环利用,能源来自太阳能,无污染且取之不尽用之不竭(两个要点,一个是物质循环、一个是能量) < BD ![]() k逆=
k逆=![]() 1.95×10-3 A、E
1.95×10-3 A、E
【解析】
(1)依据盖斯定律计算;
(2)从流程图可知,该过程中物质能够循环利用,能源来自太阳能,洁净无污染;该反应气体系数减小,是个熵值减小的反应;
(3)A、活化能越小反应速率越快;
B、K只与温度有关;
C、依据速率公式计算判断;
D、不同的催化剂对同一个反应活化能改变程度不同;
(4)①表中第一组,由HI分解建立平衡,表中第二组向逆反应进行建立平衡;
②到达平衡时,正、逆反应速率相等;
③对于2HI(g)H2(g)+I2(g)反应建立平衡时,升高温度,正、逆反应速率均加快,对于H2(g)+I2(g)2HI(g)反应建立平衡时,升高温度,正、逆反应速率均加快,升高温度,平衡向吸热反应方向移动。
(1)2HI(aq)H2(g)+I2(g)△H1①SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g)△H2②2H2SO4(l)2H2O(g)+2SO2(g)+O2(g)△H3③2H2O(g)=2H2(g)+O2(g)△H4④,根据盖斯定律①×2+②×2+③得2H2O(g)=2H2(g)+O2(g),所以△H4=2△H1+2△H2+△H3 ,故答案为:2△H1+2△H2+△H3 ;
(2)从流程图可知,该过程中物质能够循环利用,能源来自太阳能,洁净无污染,且取之不尽,用之不竭;SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g),该反应气体系数减小,是个熵值减小的反应,即△S<0,在150℃下能自发进行说明△H-T△S<0,结合△S<0可以判断△H<0,故答案为:物质循环利用,能源来自太阳能,无污染且取之不尽用之不竭(两个要点,一个是物质循环、一个是能量);<;
(3)A.根据图表可知在0~4小时,三种不同催化剂作用下反应速率v(A)>v(B)>v(C),活化能越小反应速率越快,故活化能顺序为:Ea(A)<Ea(B)<Ea(C),故A错误;
B.K只与温度有关,K不变说明温度不变,反应达到平衡状态,故B正确;
C.根据图象判断0~4小时生成氧气的物质的量为5000μmol,所以v(O2)=![]() =1250μmolh-1,故C错误;
=1250μmolh-1,故C错误;
D.不同的催化剂对同一个反应活化能改变程度不同,活化能不同,活化分子百分数不同,故D正确;
BD正确,故答案为:BD;
(4)①表中第一组,由HI分解建立平衡,表中第二组向逆反应进行建立平衡,由第一组数据可知,平衡时HI物质的量分数为0.784,则氢气、碘蒸气总物质的量分数为1-0.784=0.216,而氢气、与碘蒸气物质的量分数相等均为0.108,反应前后气体体积不变,用物质的量分数代替浓度计算平衡常数,则平衡常数K=![]() =
=![]() ,故答案为:
,故答案为:![]() ;
;
②到达平衡时,正、逆反应速率相等,则k正x2(HI)=k逆x(H2)x(I2),则k逆=k正×![]() =
=![]() ,在t=40min时,正反应建立平衡时x(HI)=0.85,则v正=k正x2(HI)=0.0027min-1×0.852=1.95×10-3min-1,故答案为:k逆=
,在t=40min时,正反应建立平衡时x(HI)=0.85,则v正=k正x2(HI)=0.0027min-1×0.852=1.95×10-3min-1,故答案为:k逆=![]() ;1.95×10-3;
;1.95×10-3;
③对于2HI(g)H2(g)+I2(g)反应建立平衡时,升高温度,正、逆反应速率均加快,因此排除C点,正反应为吸热反应,升高温度,平衡向吸热反应方向移动,因此平衡正向移动,再次平衡时HI的物质的量分数减小,因此排除B点,故选A点;对于H2(g)+I2(g)2HI(g)反应建立平衡时,升高温度,正、逆反应速率均加快,升高温度,平衡向吸热反应方向移动,因此平衡逆向移动,再次平衡时H2的物质的量分数增大,故选E点;
因此反应重新达到平衡,v正~x(HI)对应的点为A,v逆~x(H2)对应的点为E,
A、E正确,故答案为:A、E。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案【题目】合成气(CO+H2)广泛用于合成有机物,工业上常采用天然气与水蒸气反应等方法来制取合成气。
(1)在150℃时2L的密闭容器中,将2molCH4和2molH2O(g)混合,经过15min达到平衡,此时CH4的转化率为60%。回答下列问题:
①从反应开始至平衡,用氢气的变化量来表示该反应速率v(H2)=__。
②在该温度下,计算该反应的平衡常数K=__。
③下列选项中能表示该反应已达到平衡状态的是__。
A.v(H2)逆=3v(CO)正
B.密闭容器中混合气体的密度不变
C.密闭容器中总压强不变
D.C(CH4)=C(CO)
(2)合成气制甲醚的反应方程式为2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) △H=bkJ/mol。有研究者在催化剂(Cu—Zn—Al—O和A12O3)、压强为5.OMPa的条件下,由H2和CO直接制备甲醚,结果如图所示。
CH3OCH3(g)+H2O(g) △H=bkJ/mol。有研究者在催化剂(Cu—Zn—Al—O和A12O3)、压强为5.OMPa的条件下,由H2和CO直接制备甲醚,结果如图所示。
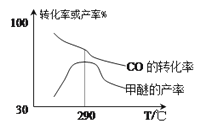
①290℃前,CO转化率和甲醚产率的变化趋势不一致的原因是__;
②b__0,(填“>”或“<”或“=”)理由是__。
(3)合成气中的氢气也用于合成氨气:N2+3H2![]() 2NH3。保持温度和体积不变,在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是__;
2NH3。保持温度和体积不变,在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是__;
A.n1=n2=3.2 B.φ甲=φ丙>φ乙 C.ν乙>ν丙>ν甲 D.P乙>P甲=P丙
容器 | 体积 | 起始物质 | 平衡时NH3的物质的量 | 平衡时N2的 体积分数 | 反应开始时的速率 | 平衡时容器内压强 |
甲 | 1L | 1molN2+3molH2 | 1.6mol | φ甲 | ν甲 | P甲 |
乙 | 1L | 2molN2+6molH2 | n1mol | φ乙 | ν乙 | P乙 |
丙 | 2L | 2molN2+6molH2 | n2mol | φ丙 | ν丙 | P丙 |