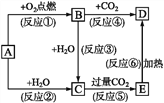
题目内容
【题目】把aL含(NH4)2SO4和NH4NO3的混和溶液分成两等份,一份加入b mol的烧碱并加热,恰好将全部NH4+转变成NH3放出;另一份需含c mol 的BaCl2溶液恰能完全沉淀SO42-,则原溶液中NO3-的物质的的浓度是( )
A. (2b-4c)/a mol/L B. (b-2c)/a mol/L
C. (2b-c)/amol/L D. (b-4c)/a mol/L
【答案】A
【解析】有关反应式为NH4++OH-=H2O+NH3↑、Ba2++SO42-=BaSO4↓,所以每一份中含有的NH4+是bmol,SO42-是cmol。因此硫酸铵中的NH4+是2cmol,则硝酸铵中的NH4+是(b-2c)mol,所以原溶液中NO3-的物质的的浓度是![]() 。答案选A。
。答案选A。

【题目】某同学想通过如图装置实验,探究SO2与Na2O2反应的产物. 
(1)Ⅰ.检验反应中是否有O2生成的方法是;若有O2生成,请写出装置C中的化学方程式 . Ⅱ.A中盛装H2SO4溶液的仪器名称是;D装置除起了防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应作用外,还可以 .
(2)Ⅲ.①C中固体产物可能只有Na2SO3、只有、Na2SO3和Na2SO4两种都有. ②若Na2O2反应完全,为确定C中固体产物的成分,该同学设计如下,请您利用限选试剂和仪器帮助他完成该探究过程,并将答案写在答题卡相应位置.
限选试剂和仪器:0.1mol/LKMnO4酸性溶液、0.01mol/LKMnO4酸性溶液、0.1mol/LBa(NO3)2溶液、0.1mol/LBaCl2溶液、1mol/L HNO3溶液、1mol/L盐酸、试管、胶头滴管.
实验操作 | 预期现象和结论 |
步骤一:取少量C中固体产物于试管中,加入适量的蒸馏水、搅拌溶解,分别取少量于A、B试管中. | 固体完全溶解,得到无色透明溶液 |
步骤二:取试管A,向溶液中加入 , 振荡,观察溶液颜色变化. | 若; |
步骤三:取试管B,向其中先加入 , 振荡;再加入 , 振荡. | 产生 , |