题目内容
【题目】在常温下,在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11.若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是多少?(要写计算过程)
【答案】解:pH=12的Ba(OH)2溶液中C(OH﹣)=10﹣2mol/L,设溶液体积为x,得到氢氧根离子物质的量为x×10﹣2mol;反应的硫酸氢钠物质的量为0.5x×10﹣2mol;设硫酸氢钠溶液体积为y,
依据反应Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH,混合后溶液pH=11,计算得到溶液中氢氧根离子浓度为10﹣3mol/L;
所以得到: ![]() =10﹣3;
=10﹣3;
得到x:y=1:4,
答:Ba(OH)2溶液与NaHSO4溶液的体积比是1:4
【解析】氢氧化钡和硫酸氢钠反应钡离子恰好沉淀,需要Ba(OH)2和NaHSO4按照物质的量1:1反应,结合溶液的pH和溶液体积换算物质的量列式计算

练习册系列答案
相关题目
【题目】工业上用某矿渣(含有Cu2O(主要)、Al2O3、Fe2O3、SiO2)提取铜的操作流程如图: 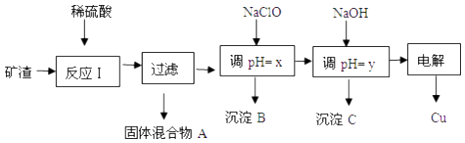
已知:Cu2O+2H+═Cu+Cu2++H2O
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
(1)固体混合物A中的成分是 .
(2)反应Ⅰ完成后,铁元素的存在形式为 . (填离子符号)请写出生成该离子的离子方程式 .
(3)沉淀B可用于制造铁红,为了保证铁红的质量则x的取值为 .
(4)书写出由沉淀C制备铝的化学方程式: .

