��Ŀ����
����Ŀ����֪ A��B��C��D��ԭ������������������ֶ���������Ԫ�أ�A������������������������ A��ԭ�Ӱ뾶С��B��Bԭ�ӵļ۵����Ų�Ϊnsnnpn��D�ǵؿ��к�������Ԫ�ء�E�ǵ������ڵ�p��Ԫ���������ֻ��2�ԳɶԵ��ӣ�FԪ�صĻ�̬ԭ�ӵ����ܲ�ֻ��һ�����ӣ������ܲ���ѳ������ӡ�
��1����̬Eԭ�ӵļ۵����Ų�ͼ_______________��
��2��B��C��D��Ԫ�ص�һ�������ɴ�С��˳��Ϊ(��Ԫ�ط��ű�ʾ)______________��
��3��BD![]() ����ԭ���ӻ����������Ϊ______�ӻ���CA
����ԭ���ӻ����������Ϊ______�ӻ���CA![]() �Ŀռ乹��Ϊ_______(����������)��
�Ŀռ乹��Ϊ_______(����������)��
��4��1 mol BC���к�����������ĿΪ______��
��5���Ƚ�D��EԪ������⻯����ȶ���_______(�ѧʽ��������������)��������_______________��
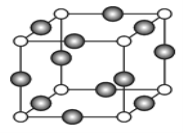
��6��C��F��Ԫ���γɵ�ij������ľ����ṹ��ͼ��ʾ����û�����Ļ�ѧʽ��____��Cԭ�ӵ���λ����_____��������Cԭ�Ӻ�Fԭ�Ӽ�ľ���Ϊanm������٤������ΪNA����þ�����ܶ�Ϊ______g/cm3(�ú�a��NA�ķ��ű�ʾ)��
���𰸡� ![]() N��O��C sp2 �������� 2NA H2O>H2Se O�ķǽ����Դ���Se( ��H2O�й��ۼ��ļ��ܸ���H2Se) Cu3N 6
N��O��C sp2 �������� 2NA H2O>H2Se O�ķǽ����Դ���Se( ��H2O�й��ۼ��ļ��ܸ���H2Se) Cu3N 6 ![]() ��
��![]()
�������������������֪ A��B��C��D��ԭ������������������ֶ���������Ԫ�أ�A������������������������A��ԭ�Ӱ뾶С��B��Bԭ�ӵļ۵����Ų�Ϊnsnnpn������n=2����BΪCԪ����AΪH��Ԫ��D�ǵؿ��к�������Ԫ������D��OԪ����CΪNԪ����E�ǵ������ڵ�p��Ԫ���������ֻ��2�ԳɶԵ��ӣ���E�ļ۵����Ų�ʽΪ4s24p4����EΪSeԪ�أ�FԪ�صĻ�̬ԭ�ӵ����ܲ�ֻ��һ�����ӣ������ܲ���ѳ�����������FΪCuԪ����
��1����̬Seԭ�ӵļ۵����Ų�ͼ![]() ��
��
��2��ͬһ����Ԫ�صĵ�һ�����ܳ�����������������Nԭ�ӵ�2p������ڽ��ȶ��İ����״̬����N�ĵ�һ�����ܸ���ͬ�����ڽ�����Ԫ�أ�C��N��O��Ԫ�ص�һ�������ɴ�С��˳��ΪN��O��C��
��3��CO![]() ����ԭ�ӵļ۵�����ĿΪ
����ԭ�ӵļ۵�����ĿΪ![]() �������ӻ����������Ϊsp2�ӻ���NH
�������ӻ����������Ϊsp2�ӻ���NH![]() ��CH4�ǵȵ����壬����ռ乹��Ϊ����������
��CH4�ǵȵ����壬����ռ乹��Ϊ����������
��4��CN����N2�ǵȵ����壬����ӽṹ�����������к������������ԣ�1 mol CN���к�����������ĿΪ2NA��
��5��O��SeԪ������⻯����ȶ���H2O��H2Se��������O�ķǽ����Դ���Se(��H2O�й��ۼ��ļ��ܸ���H2Se)��
��6�����Ρ�Cu��Ԫ���γɵĻ�����ľ����ṹ��֪���þ����а��������������![]() �����������������
�����������������![]() �����Ը���Ԫ�صij������ϼۿ����жϣ�������������ӡ����������ͭ�������û�����Ļ�ѧʽ��Cu3N��Nԭ�ӵ���λ����
�����Ը���Ԫ�صij������ϼۿ����жϣ�������������ӡ����������ͭ�������û�����Ļ�ѧʽ��Cu3N��Nԭ�ӵ���λ����![]() 6��������Nԭ�Ӻ�Cuԭ�Ӽ�ľ���Ϊa nm�����ı߳�Ϊ2a
6��������Nԭ�Ӻ�Cuԭ�Ӽ�ľ���Ϊa nm�����ı߳�Ϊ2a![]() cm��1mol Cu3N����������������ֱ�Ϊ(
cm��1mol Cu3N����������������ֱ�Ϊ(![]() )g��
)g��![]() ����þ�����ܶ�Ϊ
����þ�����ܶ�Ϊ![]() g/cm3(��
g/cm3(��![]() g/cm3)��
g/cm3)��

 ����������������ϵ�д�
����������������ϵ�д�