题目内容
【题目】在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2A+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的化学式为____________, 含有____________等化学键。
(2)生成物中含有10个电子的分子是________(写分子式),该分子的空间构型_______,中心原子的杂化方式为___________________。
(3)反应物中电负性最大的元素为________(填元素符号),写出其原子最外层的电子排布图_______________。
(4)冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,“●”位于大立方体的顶点和面心,“○”位于大立方体的12条棱的中点、大立方体的体心和8个小立方体的体心,那么大立方体的面心处所代表的微粒是__________(填微粒符号)。
(5)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:
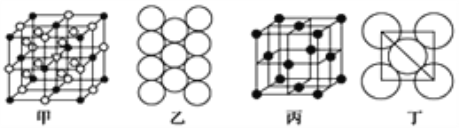
若已知Al的原子半径为r pm,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为___________个; Al晶体的密度为________ g/cm3 (用字母表示)。
【答案】 Na3AlF6 离子键 、共价键、配位键 H2O V形 sp3 F ![]() AlF
AlF![]() 4
4 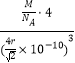
【解析】试题分析:在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2A+3CO2↑+9H2O。由质量守恒定律可知,A为Na3AlF6,其为离子化合物,含有离子键、共价键和配位键。
(1)冰晶石的化学式为Na3AlF6, 含有离子键 、共价键、配位键等化学键。
(2)生成物中含有10个电子的分子是H2O,其中O的价层电子对数为4,故其杂化类型为sp3杂化,H2O分子空间构型为V形。
(3)反应物中电负性最大的元素为F,其原子最外层的电子排布图为![]() 。
。
(4)冰晶石由两种微粒构成,由冰晶石的晶胞结构示意图可知,“●”位于大立方体的顶点和面心,则“●”共有![]() 4个;“○”位于大立方体的12条棱的中点和8个小立方体的体心,则“○”共有
4个;“○”位于大立方体的12条棱的中点和8个小立方体的体心,则“○”共有![]() ,两种微粒的个数比为1:3,所以,大立方体的面心处所代表的微粒是AlF
,两种微粒的个数比为1:3,所以,大立方体的面心处所代表的微粒是AlF![]() 。
。
(5)由乙、丙、丁可知,Al的晶胞为面心立方则一个晶胞中Al原子的数目为![]() 4个;。若已知Al的原子半径为r pm,则晶胞的边长为
4个;。若已知Al的原子半径为r pm,则晶胞的边长为![]() pm=
pm=![]() ;NA代表阿伏加德罗常数,Al的相对原子质量为M,则1mol 晶胞的质量和体积分别4M g为和
;NA代表阿伏加德罗常数,Al的相对原子质量为M,则1mol 晶胞的质量和体积分别4M g为和![]() ,Al晶体的密度为
,Al晶体的密度为![]() g/cm3。
g/cm3。

【题目】下列陈述I、Ⅱ正确并且有因果关系的是 ( )
选项 | 表述I | 表述II |
A | SO2有漂白性 | SO2可使溴水褪色 |
B | ClO2有强氧化性 | ClO2可用于自来水消毒 |
C | 常温下铁与浓硫酸不反应 | 可用铁槽车密封运送浓硫酸 |
D | NH3·H2O具有碱性 | NH3可使干燥的蓝色石蕊试纸变红 |
A.AB.BC.CD.D