题目内容
16.常温时,下列试剂能用铁制容器盛放的是( )| A. | 胆矾溶液 | B. | 浓食盐 | C. | 浓硝酸 | D. | 浓AlCl3溶液 |
分析 A、铁与硫酸铜溶液发生置换反应;
B、浓食盐与铁制容器构成原电池,发生电化学腐蚀;
C、铁在浓硝酸中发生钝化现象;
D、氯化铝溶液是强酸弱碱盐溶液水解呈酸性,能腐蚀铁.
解答 解:A、铁与硫酸铜溶液发生置换反应,所以铁制容器不能盛放胆矾溶液,故A错误;
B、浓食盐与铁制容器构成原电池,发生吸氧腐蚀,所以铁因发生电化学腐蚀而溶解,故B错误;
C、铁在浓硝酸中发生钝化现象,表面形成致密的氧化膜,保护了铁,所以能用铁制容器盛放浓硝酸,故C正确;
D、氯化铝溶液是强酸弱碱盐溶液水解呈酸性,能腐蚀铁,故D错误;
故选D.
点评 本题考查学生金属铁的性质,注意常温下浓硫酸、浓硝酸遇到金属铁会发生钝化这一知识点,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.一定条件下,向容积为2L的密闭容器中充入一定量A和足量B,发生反应如下:2A(g)+B(s)?2C(g),测得相关数据如下,分析可知下列说法不正确的是( )
| 实验Ⅰ | 实验Ⅱ | 实验Ⅲ | |
| 反应温度/℃ | 800 | 800 | 850 |
| c(A)起始/mol•L-1 | 1 | 2 | 1 |
| c(A)平衡/mol•L-1 | 0.5 | 1 | 0.85 |
| 放出的热量/kJ | a | b | c |
| A. | 实验Ⅲ的化学平衡常数K<1 | |
| B. | 实验放出的热量关系为b=2a | |
| C. | 实验Ⅲ在30 min达到平衡,30 min内A的速率:v(A)=0.002 5 mol•L-1•min-1 | |
| D. | 当容器内气体密度不随时间而变化时上述反应达到平衡 |
1.某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的离子组是( )
| A. | K+、Na+、HCO3-、NO3- | B. | Ag+、K+、NO3-、Na+ | ||
| C. | H+、Mg2+、SO42-、NO3- | D. | Na+、SO42-、Cl-、ClO- |
8.锶(Sr)为第五周期ⅡA族元素.高纯六水氯化锶晶体(SrCl2•6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水.用工业碳酸锶粉末(含少量Ba、Fe的化合物)制备高纯六水氯化锶的过程如图.
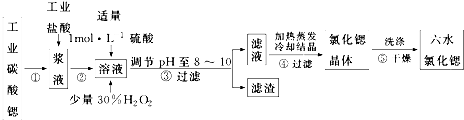
请回答:(1)步骤③中调节溶液pH至8~10,宜选用的试剂为BD.
A.稀硫酸 B.氢氧化锶粉末 C.氢氧化钠 D.氧化锶粉末
所得滤渣的主要成分是BaSO4、Fe(OH)3(填化学式).
(2)若滤液中Ba2+ 浓度为1×10-5mol•L-1,依据下表数据可以推算滤液中Sr2+物质的量浓度为不大于0.03mol/L.

请回答:(1)步骤③中调节溶液pH至8~10,宜选用的试剂为BD.
A.稀硫酸 B.氢氧化锶粉末 C.氢氧化钠 D.氧化锶粉末
所得滤渣的主要成分是BaSO4、Fe(OH)3(填化学式).
(2)若滤液中Ba2+ 浓度为1×10-5mol•L-1,依据下表数据可以推算滤液中Sr2+物质的量浓度为不大于0.03mol/L.
| SrSO4 | BaSO4 | Sr(OH)2 | Fe(OH)3 | Fe(OH)2 | |
| Ksp | 3.3×10-7 | 1.1×10-10 | 3.2×10-4 | 2.6×10-39 | 4.87×10-17 |
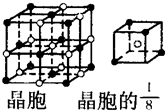 A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高氧化物的水化物两两混合均能发生反应生成盐和水.
A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高氧化物的水化物两两混合均能发生反应生成盐和水. ”表示)位于该正方体的顶点或面心;阴离子(用“
”表示)位于该正方体的顶点或面心;阴离子(用“ ”表示)均位于小正方体中心.该化合物的电子式是
”表示)均位于小正方体中心.该化合物的电子式是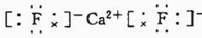 .
.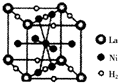 镍及其化合物在合金材料以及催化剂等方面应用广泛.
镍及其化合物在合金材料以及催化剂等方面应用广泛. ④HCHO,其中碳原子采取sp2杂化有①③④,HCHO分子内σ键与π键个数之比为3:1.
④HCHO,其中碳原子采取sp2杂化有①③④,HCHO分子内σ键与π键个数之比为3:1.