题目内容
(1)下列四种粒子中,半径按由大到小的排列顺序是 。
①基态X的原子结构示意图:○+16
②基态Y的价电子排布式:3s23p5
③基态Z2-的电子排布图: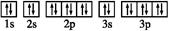
④W基态原子有2个能层,电子式:∶∶
(2)已知An+、B(n+1)+、Cn-、D(n+1)-都具有相同的电子层结构,则A、B、C、D的原子半径由大到小的顺序是 ,离子半径由大到小的顺序是 ,原子序数由大到小的顺序是 。
(1)③>①>②>④
(2)A>B>D>C D>C>A>B B>A>C>D
解析试题分析:(1)①X是S原子,②Y是Cl原子,③Z2-是S2-,④W是C原子,根据半径的比较规律,所以半径的大小顺序是③>①>②>④
(2)根据“阴上阳下”的原则,C、D在上一周期,A、B在下一周期;D所带负电荷多,说明D在C的左侧,B带的正电荷多,说明B在A的右侧,A、B、C、D的相对位置如图: D C A B
所以原子半径的大小关系是A>B>D>C;离子的电子层结构相同,核电荷数越多,半径越小,所以离子半径的顺序是D>C>A>B;原子序数的大小顺序是B>A>C>D。
考点:考查元素原子的判断,结构与位置的关系应用,半径的比较

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案某学生在做元素性质与原子结构关系的实验时,设计了一套实验方案,并记录了有关的实验现象。请帮助该学生整理并完成实验报告。
(1)实验目的
探究同一主族元素性质的递变规律。
(2)实验用品
仪器:试管、胶头滴管
药品:新制氯水、新制溴水、溴化钠溶液、碘化钠溶液、四氯化碳
(3)实验内容(在下表横线中填写相关内容)
| 序号 | 实验方案 | 实验现象 |
| ① | 向盛有少量溴化钠溶液的试管中滴加少量新制氯水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈_____色 |
| ② | 向盛有少量碘化钠溶液的试管中滴加少量新制溴水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈_____色 |
(4)实验结论:_________________________________。
(5)问题和讨论
①上述两个实验中发生反应的离子方程式分别为________________、__________________。
②由于氟单质过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱。试列举两项事实说明氟的非金属性比氯的强:______________、______________。
下列各元素的原子在形成不同物质时,既能形成非极性键,也能形成极性键,还能形成离子键的是( )。
| A.Na | B.Fe | C.C | D.Ne |
在以离子键为主的化学键中常含有共价键的成分。下列各组原子形成化学键中共价键成分最少的是( )
| A.Li,F | B.Na,Cl | C.Na,F | D.Mg,O |
意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示。已知断裂1mol N-N吸收167kJ热量,生成1 mol N≡N放出942kJ热量,根据以上信息判断,下列说法正确的是
| A.1mol N4转变成N2将放出882kJ热量 | B.N4属于一种新型的化合物 |
| C.N4与N2互为同分异构体 | D.N4是由极性键组成的分子 |
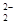 存在,使晶胞沿一个方向拉长,则CaC2晶体中1个C
存在,使晶胞沿一个方向拉长,则CaC2晶体中1个C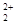 互为等电子体,O
互为等电子体,O