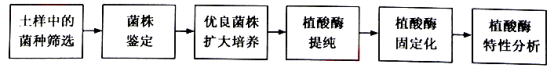
��Ŀ����
����Ŀ��ij��Һ�п��ܺ���OH����CO ![]() ��AlO2����SiO
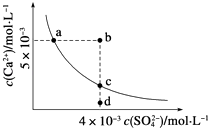
��AlO2����SiO ![]() ��SO42����HCO3����Na+��Fe3+��Mg2+��Al3+�����ӣ��������Һ����μ���һ�����ʵ���Ũ�ȵ�������Һʱ���������ɳ��������ʵ�����������Һ������仯��ͼ����ͼ��ʾ������˵����ȷ���ǣ� ��
��SO42����HCO3����Na+��Fe3+��Mg2+��Al3+�����ӣ��������Һ����μ���һ�����ʵ���Ũ�ȵ�������Һʱ���������ɳ��������ʵ�����������Һ������仯��ͼ����ͼ��ʾ������˵����ȷ���ǣ� �� 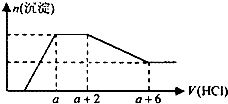
A.ԭ��Һ��һ�����е��������ǣ�OH����SiO ![]() ��AlO
��AlO ![]() ��CO
��CO ![]()
B.��Ӧ����γɵ���Һ�е�����ΪNaCl
C.ԭ��Һ��һ������Na2SO4
D.ԭ��Һ�к���CO ![]() ��AlO
��AlO ![]() ?�����ʵ���֮��Ϊ1��2
?�����ʵ���֮��Ϊ1��2
���𰸡�A
���������⣺��ͼ�������֪����ʼ��������˵��������������Һ�еļӦ��˵����Һ��һ����OH�����ӣ��������������Ӳ��ܹ��������ΪFe3+��Mg2+��Al3+�����Ӧ���ɳ���������˵����AlO ![]() ��SiO
��SiO ![]() �������ӷ�Ӧ�����������������������������AlO
�������ӷ�Ӧ�����������������������������AlO ![]() ��HCO
��HCO ![]() ������Ӧ����������������������Һ��һ��������HCO
������Ӧ����������������������Һ��һ��������HCO ![]() ����������������������䣬�������������ֻ����CO
����������������������䣬�������������ֻ����CO ![]() ���ӣ���Ӧ�������������ᣬ������С�������ٸı䣬��һ��֤��������������������������������������������ᣬ���ʣ�����Ϊ�����������Ӳ���ȷ�����ڣ���������Һ�ĵ����Կ�֪����Һ��һ������Na+���ӣ� A�������ж�ԭ��Һ��һ�����е��������ǣ�OH����SiO
���ӣ���Ӧ�������������ᣬ������С�������ٸı䣬��һ��֤��������������������������������������������ᣬ���ʣ�����Ϊ�����������Ӳ���ȷ�����ڣ���������Һ�ĵ����Կ�֪����Һ��һ������Na+���ӣ� A�������ж�ԭ��Һ��һ�����е��������ǣ�OH����SiO ![]() ��AlO
��AlO ![]() ��CO
��CO ![]() ����A��ȷ��
����A��ȷ��
B����Ӧ����γɵ���Һ�е�����ΪNaCl��AlCl3 �� ��B����
C����Һ����������Ӳ���ȷ����ʣ��ԭ��Һ����һ������Na2SO4 �� ��C����
D������ͼ���֪��̼������ӷ�Ӧ������Ϊ2�����CO ![]() +2H+=CO2��+H2O ���������ܽ����ĵ��������Ϊ4�����Al��OH��3+3H+=Al3++3H2O��ԭ��Һ�к���CO
+2H+=CO2��+H2O ���������ܽ����ĵ��������Ϊ4�����Al��OH��3+3H+=Al3++3H2O��ԭ��Һ�к���CO ![]() ��AlO
��AlO ![]() �����ʵ���֮��Ϊ3��4����D����
�����ʵ���֮��Ϊ3��4����D����
��ѡA��