题目内容
【题目】下图是某儿童微量元素体检报告单的部分数据:
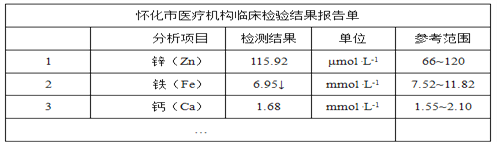
根据上表的数据,回答下列问题:
(1)该儿童__元素含量偏低。
(2)报告单中“μmol·L-1”是__(填“质量” “体积”或“浓度”)的单位。
(3)服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中维生素C表现出__________(填“氧化性”或“还原性”)。
(4)硫酸亚铁晶体(FeSO47H2O)在医疗上可作补血剂。某课外小组测定该补血剂(每片b克)中铁元素的含量。实验步骤如图:
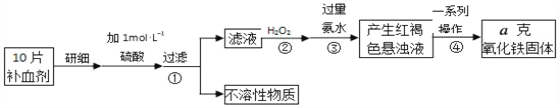
请回答下列问题:
a.②中H2O2的作用是__。
b.④中一系列处理的操作步骤为过滤、______、灼烧、冷却、称量。
c. 下列操作会导致所测定的铁元素含量偏高的是__。
A.步骤③所加氨水量不足 B.步骤④洗涤不充分 C.步骤④灼烧不充分
d. 写出步骤③中发生的离子方程式_____________________________________
e、简述滤液中存在Fe3+的检验方法是:_______________________________________
【答案】 铁(或Fe) 浓度 还原性 将Fe2+全部氧化为Fe3+ 洗涤 BC Fe3++3NH3·H2O =Fe(OH)3↓+3NH4+ 取少许滤液于试管中,滴几滴硫氰化钾溶液,溶液迅速出现血红色,证明存在铁离子
【解析】(1)根据体检报告单,铁(或Fe)元素含量偏低,故答案为:铁(或Fe);
(2)报告单中μmol/L是浓度的单位,故答案为:浓度;
(3)服用维生素C可使食物中的Fe3+转化为Fe2+,Fe元素的化合价降低被还原,则则维生素C所起还原作用,故答案为:还原性;
(4)由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量。
a.双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,故答案为:将Fe2+全部氧化为Fe3+;
b步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,故答案为:洗涤;
c.A、步骤③所加氨水量不足,铁离子沉淀不完全,生成的氢氧化铁减少,氧化铁质量减少,测定结果偏低,故A错误;B、步骤④洗涤不充分,会导致氧化铁的质量偏大,测得的铁元素质量分数偏大,故B正确;C、步骤④灼烧不充分,会导致氧化铁固体的质量偏大,铁元素质量分数偏大,故C正确;故选BC;
d. 写出步骤③中铁离子与氨水反应生成氢氧化铁沉淀,反应的离子方程式为Fe3++3NH3·H2O =Fe(OH)3↓+3NH4+,故答案为:Fe3++3NH3·H2O =Fe(OH)3↓+3NH4+;
e、检验Fe3+可以利用硫氰化钾溶液,方法是取少许滤液于试管中,滴几滴硫氰化钾溶液,溶液迅速出现血红色,证明存在铁离子,故答案为:取少许滤液于试管中,滴几滴硫氰化钾溶液,溶液迅速出现血红色,证明存在铁离子。

【题目】碳酸钙、盐酸是中学化学实验中的常用试剂.
(1)甲同学拟测定CaCO3固体与过量0.1molL﹣1 HCl的反应速率.
①该反应的离子方程式为 .
②设计实验方案:通过测量计算反应速率
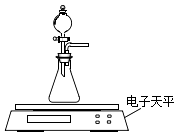
(2)乙同学拟用如图装置探究固体表面积和反应物浓度对化学反应速率的影响.电子天平限选试剂与用品:0.1molL﹣1 HCl、颗粒状CaCO3、粉末状CaCO3、蒸馏水、量筒、秒表
(i)设计实验方案:在反应物浓度或固体表面积不同的条件下,测定
(要求所测得的数据能直接体现反应速率大小).
(ⅱ) 根据(i)中设计的实验测定方案,拟定实验表格,完整体现实验方案.列出所用试剂的用量、待测物理量;数据用字母a、b、c、d表示.
已知实验1和2探究固体表面积对反应速率的影响;
实验1和3探究反应物浓度对反应速率的影响.
写出表中①﹣⑥所代表的必要数据或物理量
物理量 | V(0.1molL﹣1 HCl)/mL | m(颗粒状CaCO3)/g | m(粉末状CaCO3)/g | V(蒸馏水)/mL | ⑤ | ⑥ |
实验1 | a | b | 0 | c | d | |
实验2 | 0 | c | d | |||
实验3 | c | 0 | d |