题目内容
【题目】运用元素周期律研究元素及其化合物的性质具有重要的意义.
(1)部分短周期主族元素的最高价氧化物对应的水化物(浓度均为0.01molL﹣1)溶液的PH和原子序数的关系如图所示. 
(i)元素R在周期表中的位置是
(ii)元素Y和W形成的Y2W2型化合物中含有化学键的类型为
(iii)请写出X的最高价氧化物对应的水化物与其气态氢化物的离子反应方程式
(2)短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等
(i)下列能说明碳、硫两种元素非金属性相对强弱的是(填序号)
A.S与H2发生化合反应比C与H2化合更容易
B.酸性:H2SO3>H2CO3
C.稳定性:CH4<H2S
(ii)羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和CO2相似
①羰基硫(COS)的电子式为:
②羰基硫(COS)用氢氧化钠溶液处理及利用的过程如图:
已知A是一种正盐,则反应I的化学反应方程式为 .
【答案】
(1)第三周期第ⅦA族;离子键、非极性共价键;H++NH3=NH4+
(2)AC;![]() ;COS+4NaOH=Na2S+Na2CO3+2H2O
;COS+4NaOH=Na2S+Na2CO3+2H2O
【解析】解:(1)由题意X、Y、Z、W、R是短周期主族元素且原子序数依次增大,最高价氧化物对应的水化物(浓度均为0.01mol.L﹣1)溶液的PH,Y对应PH=12,说明Y是钠,X对应PH=2,X是氮,Z对应PH>2,所以Z是磷,W对应PH<2,所以W是S;R对应PH=2原子序数最大,所以R是Cl.(i)元素R在周期表中的位置是:第三周期第ⅦA族,所以答案是:第三周期第ⅦA族;(ii)元素Y和W形成的Y2W2型化合物是Na2S2中含有化学键的类型为:离子键、非极性共价键,所以答案是:离子键、非极性共价键(iii)X的最高价氧化物对应的水化物与其气态氢化物的离子反应方程式为H++NH3=NH4+ , 所以答案是:H++NH3=NH4+;(2)(i)A.S与H2发生化合反应比C与H2化合更容易,则能说明碳与硫两元素非金属性相对强弱关系为:S>C,故A正确;
B.酸性:H2SO3>H2CO3 , 亚硫酸不是最高价含氧酸,不能说明碳与硫两元素非金属性相对强弱,故B错误;
C.稳定性:CH4<H2S,能说明碳与硫两元素非金属性相对强弱关系为:S>C,故C正确;
所以答案是:AC;(ii)由流程可知,COS与氢氧化钠反应,根据原子守恒,A溶液应该是含C的正盐,所以A为Na2CO3;硫化钠溶液加热生成Na2S2O3和气体,由原子守恒,气体a应该是氢气,①羰基硫(COS)的电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;②由上述分析可知,A是Na2CO3;气体a应该是氢气,结合电子、原子、电荷守恒可知反应Ⅱ为2S2﹣+5H2O
;②由上述分析可知,A是Na2CO3;气体a应该是氢气,结合电子、原子、电荷守恒可知反应Ⅱ为2S2﹣+5H2O ![]() S2O32﹣+4H2+2OH﹣ , 则反应I为COS+4NaOH=Na2S+Na2CO3+2H2O,所以答案是:COS+4NaOH=Na2S+Na2CO3+2H2O.
S2O32﹣+4H2+2OH﹣ , 则反应I为COS+4NaOH=Na2S+Na2CO3+2H2O,所以答案是:COS+4NaOH=Na2S+Na2CO3+2H2O.

【题目】海水资源丰富,海水中主要含有Na+、K+、Mg2+、Cl﹣、SO42﹣、Br﹣、CO32﹣HCO3﹣等离子.合理利用海水资源和保护环境是我国可持续发展的重要保证.
(1)火力发电燃烧煤排放的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如图所示: 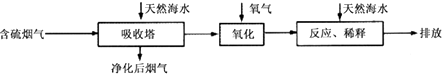
(i)天然海水的pH≈8,呈弱碱性.用离子方程式解释主要原因 .
(ii)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是;氧化后的“海水”需要用大量的天然海水与之混后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸.
(iii)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=(用含硫微粒浓度的代数式表示).
(iv)相同物质的量的SO2与NH3溶于水发生反应的离子方程式为 , 所得溶液中c(H+)﹣c(OH﹣)=(填字母编号).
A.c(SO32﹣)﹣c(H2SO3) B.c(SO32﹣)+c(NH3 . H2O)﹣c(H2SO3)
C.c(HSO3﹣)+c(SO32﹣)﹣c(NH4+) D.c(HSO3﹣)+2c(SO32﹣)﹣c(NH4+)
(2)重金属离子对河流及海洋造成严重污染.某化工厂废水(pH=2.0,ρ≈1g/mL)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.1mol/L.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
难溶 | AgI | AgOH | Ag2S | pbI2 | Pb(OH)2 | PbS |
Ksp | 8.3×10﹣17 | 5.6×10﹣8 | 6.3×10﹣50 | 7.1×10﹣9 | 1.2×10﹣15 | 3.4×10﹣28 |
(i)你认为往废水中投入(填字母序号),沉淀效果最好.
A.NaOH B.Na2S C.KI D.Ca(OH)2
(ii)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)= .
(iii)如果用食盐处理只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%(ρ≈1gmL﹣1).若环境要求排放标准为c(Ag+)低于1.0×10﹣8mol/L,问该工厂处理后的废水中c(Ag+)= . (已知KSP(AgCl)=1.8×10﹣10)