��Ŀ����
����Ŀ����ˮ��Դ�ḻ����ˮ����Ҫ����Na+��K+��Mg2+��Cl����SO42����Br����CO32��HCO3�������ӣ��������ú�ˮ��Դ�ͱ����������ҹ��ɳ�����չ����Ҫ��֤��
��1����������ȼ��ú�ŷŵ�SO2�����һϵ�л�������̬���⣮���ú�ˮ������һ����Ч�ķ������乤��������ͼ��ʾ�� 
��i����Ȼ��ˮ��pH��8���������ԣ������ӷ���ʽ������Ҫԭ�� ��
��ii����Ȼ��ˮ�����˺���������Ҫ��O2���������������䷴Ӧ�Ļ�ѧ����ʽ����������ġ���ˮ����Ҫ�ô�������Ȼ��ˮ��֮�������ŷţ��ò�������ҪĿ�����к͡�ϡ�;�����������ˮ�����ɵ��ᣮ
��iii�������е�SO2����ijŨ��NaOH��Һ���յõ�Na2SO3��NaHSO3�����Һ����������Һ�����ԣ�����Һ��c��Na+��=���ú�����Ũ�ȵĴ���ʽ��ʾ����
��iv����ͬ���ʵ�����SO2��NH3����ˮ������Ӧ�����ӷ���ʽΪ �� ������Һ��c��H+����c��OH����=������ĸ��ţ���
A��c��SO32������c��H2SO3�� B��c��SO32����+c��NH3 �� H2O����c��H2SO3��
C��c��HSO3����+c��SO32������c��NH4+�� D��c��HSO3����+2c��SO32������c��NH4+��
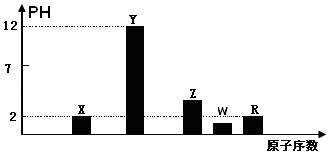
��2���ؽ������ӶԺ������������������Ⱦ��ij��������ˮ��pH=2.0���ѡ�1g/mL���к���Ag+��Pb2+���ؽ������ӣ���Ũ�ȸ�ԼΪ0.1mol/L���ŷ�ǰ���ó�������ȥ���������ӣ������й��������£�
���� | AgI | AgOH | Ag2S | pbI2 | Pb��OH��2 | PbS |
Ksp | 8.3��10��17 | 5.6��10��8 | 6.3��10��50 | 7.1��10��9 | 1.2��10��15 | 3.4��10��28 |
��i������Ϊ����ˮ��Ͷ��������ĸ��ţ�������Ч����ã�
A��NaOH B��Na2S C��KI D��Ca��OH��2
��ii���������ʯ�Ҵ���������ˮ��ʹ��Һ��pH=8.0��������ķ�ˮ��c��Pb2+��= ��
��iii�������ʳ�δ���ֻ��Ag+�ķ�ˮ����ô�����ķ�ˮ��NaCl����������Ϊ0.117%���ѡ�1gmL��1����������Ҫ���ŷű�Ϊc��Ag+������1.0��10��8mol/L���ʸù���������ķ�ˮ��c��Ag+��= �� ����֪KSP��AgCl��=1.8��10��10��
���𰸡�
��1��CO32��+H2O?HCO3��+OH����HCO3��+H2O?H2CO3+OH����2H2SO3+O2�T2H2SO4��2c��SO32����+c��HSO3������SO2+NH3?H2O=NH4++HSO3����BD
��2��B��1.2��10��3mol?L��1��9��10��9 mol?L��1
���������⣺��1����i����ˮ����Ҫ����Na+��K+��Mg2+��Cl����SO42����Br����CO32����HCO��3�����ӣ�����Щ�������ܷ���ˮ�����CO32����HCO��3���ӣ�CO32��+H2OHCO3��+OH�� �� HCO3��+H2OH2CO3+OH������ˮ��ʼ��ԣ�������Ȼ��ˮ��pH��8���������ԣ�
���Դ��ǣ�CO32��+H2OHCO3��+OH����HCO3��+H2OH2CO3+OH������ii����Ȼ��ˮ�����˺���������Ҫ��O2��������������������H2SO3����Ϊ���ᣬ�÷�ӦΪ2H2SO3+O2=2H2SO4 �� ������ġ���ˮ����Ҫ�ô�������Ȼ��ˮ��֮��Ϻ�����ŷţ������к�ϡ�;�����������ˮ�����ɵ��ᣨH+����
���Դ��ǣ�2H2SO3+O2�T2H2SO4����iii�������е�SO2����ijŨ��NaOH��Һ���յõ�Na2SO3��NaHSO3�����Һ����������Һ�����ԣ���Һ�д��ڵ���غ�c��Na+��+c��H+��=2c��SO32����+c��HSO3����+c��OH������c��H+��=c��OH�������õ�c��Na+��=2c��SO32����+c��HSO3������
���Դ��ǣ�2c��SO32����+c��HSO3��������iv����ͬ���ʵ�����SO2��NH3����ˮ������Ӧ����̼����泥���Ӧ�����ӷ���ʽΪSO2+NH3+H2O�TNH4++HSO3�� �� ��Һ�д��ڵ���غ㣺c��HSO3����+2c��SO32����+c��OH����=c��H+��+c��NH4+����c��H+����c��OH����=c��HSO3����+2c��SO32������c��NH4+����D��ȷ��C������Һ�д��������غ㣺c��NH4+��+c��NH3H2O��=c��HSO3����+c��SO32����+c��H2SO3������ϵ���غ�������غ��֪c��H+����c��OH����=c��HSO3����+2c��SO32������c��NH4+��=c��SO32����+c��NH3 �� H2O����c��H2SO3��������A����B��ȷ�����Դ��ǣ�SO2+NH3+H2O�TNH4++HSO3����BD����2����i���ɱ����е����ݿ�֪���ܶȻ�ԽС��Խ��ת��Ϊ��������Ȼֻ��������ܶȻ�С����Ӧѡ�����ƣ�
���Դ��ǣ�B����ii����Pb��OH��2���ܶȻ�Ϊ1.2��10��15 �� pH=8.0��c��OH����=10��6molL��1 �� ��c��Pb2+��= ![]() =1.2��10��3molL��1 ��
=1.2��10��3molL��1 ��
���Դ��ǣ�1.2��10��3molL��1����iii����ˮ��NaCl����������Ϊ0.117%���ѡ�1gmL��1����c��Cl����=c��NaCl��= ![]() =0.02mol/L��
=0.02mol/L��
Ksp��AgCl��=c��Ag+��c��Cl����=1.8��10��10mol2L��2 �� ��c��Ag+��= ![]() =9��10��9molL��1 �� ����Ҫ���ŷű�Ϊc��Ag+������1.0��10��8molL��1 �� ��Ȼ9��10��9molL��1��1.0��l0��8molL��1 ��
=9��10��9molL��1 �� ����Ҫ���ŷű�Ϊc��Ag+������1.0��10��8molL��1 �� ��Ȼ9��10��9molL��1��1.0��l0��8molL��1 ��
���Դ��ǣ�9��10��9molL��1 ��

����Ŀ���״�����Ҫ�Ļ�ѧ��ҵ����ԭ�Ϻ����Һ��ȼ�ϣ���ҵ�Ͽ�����CO��CO2������ȼ�ϼ״�����֪�״��Ʊ����йػ�ѧ��Ӧ�Լ��ڲ�ͬ�¶��µĻ�ѧ��Ӧƽ�ⳣ�����±���ʾ��
��ѧ��Ӧ��ƽ�ⳣ�� | �¶�/�� | ||
500 | 800 | ||
��2H2��g��+CO��g��CH3OH��g����H1 | K1 | 2.5 | 0.15 |
��H2��g��+CO2��g��CO��g��+H2O��g����H2 | K2 | 1.0 | 2.50 |
��3H2��g��+CO2��g��CH3OH��g��+H2O��g����H3 | K3 | ||
��1����Ӧ�ڵķ�Ӧ�ȡ�H20�����������������=������
��2��ij�¶��·�Ӧ����H2��ƽ��ת���ʣ�a������ϵ��ѹǿ��P���Ĺ�ϵ��ͼ1��ʾ����ƽ��״̬��A�䵽Bʱ��ƽ�ⳣ��K��A��K��B�� �����������������=������
��3�����ݷ�Ӧ����ڿ��Ƶ���K1��K2��K3֮��Ĺ�ϵ����K3=����K1��K2��ʾ����500��ʱ��÷�Ӧ����ijʱ��H2��g����CO2��g����CH3OH��g����H2O��g����Ũ�ȣ�mol/L���ֱ�Ϊ0.8��0.1��0.3��0.15�����ʱv������v���棩 �����������������=������
��4����3L�ݻ��ɱ���ܱ������з�����Ӧ�ڣ���֪c��CO���뷴Ӧʱ��t�仯���ߢ���ͼ2��ʾ������t0ʱ�̷ֱ�ı�һ�����������ߢ��Ϊ���ߢ�����ߢ����ߢ��Ϊ���ߢ�ʱ���ı���������������ߢ��Ϊ���ߢ�ʱ���ı���������� 
��5��һ�������¼״���һ����̼��Ӧ���Ժϳ����ᣮͨ��״���£���amol/L��������bmol/LBa��OH��2��Һ�������ϣ���Ӧƽ��ʱ��2c��Ba2+��=c��CH3COO�������ú�a��b�Ĵ���ʽ��ʾ�û����Һ������ĵ��볣��Ϊ ��