��Ŀ����
4����1����֪����ͼ1�����ת����
�Իش��������⣺
��д��B�Ļ�ѧʽFeCl2��D�Ļ�ѧʽKCl��
��д����Eת���F�Ļ�ѧ����ʽ4Fe��OH��2+2H2O+O2=4Fe��OH��3��
��д����KSCN����G������Һ��ΪѪ��ɫ����G��Һ����A���й����ӷ�Ӧ����ʽFe+2Fe3+=3Fe2+��
��2����MgCl2��AlCl3�Ļ����Һ�У���μ���NaOH��Һֱ�����������ⶨ������NaOH���ʵ�����mol�������ó��������ʵ�����mol���Ĺ�ϵ��ͼ2��ʾ����
��д���������߶η�����Ӧ�����ӷ���ʽ��
OD��Al3++3OH-=Al��OH��3����Mg2++2OH-=Mg��OH��2����
DC��Al��OH��3+OH-=AlO2-+2H2O��
��ԭ��Һ��Mg2+��Al3+���ʵ���Ũ��֮��Ϊ2��1��
��ͼ2��C���ʾ��������0.8mol NaOHʱ��Al3+�Ѿ�ת��ΪAlO2-��Mg2+�Ѿ�ת��ΪMg��OH��2��
��ͼ2���߶�OA��AB=7��1��
���� ��1����ת����ϵ��֪���ɰ�ɫ����E�ڿ�����ת��Ϊ���ɫ����F����EΪFe��OH��2��FΪFe��OH��3����ҺD����������Һ�õ���ɫ����H��������Һ��ɫ��ӦΪ��ɫ���ʺ���K+����ɫ����HΪAgCl����DΪKCl������ҺC+��ҺB��KCl+Fe��OH��2��ΪFeCl2��KOH�ķ�Ӧ��Fe��OH��3�����ᷴӦ�õ�G��G��A��Ӧ�õ�B����֪BΪFeCl2��CΪKOH��GΪFeCl3��AΪFe���ݴ˽��
��2����OD���ǣ�MgCl2���������Ʒ�Ӧ����������þ�������Ȼ��ƣ�AlCl3���������Ʒ�Ӧ�������������������Ȼ��ƣ�DC���������������������Ʒ�Ӧ����ƫ��������ˮ��
����ͼ��֪�����������Ϊ0.3mol����������СΪ0.2mol����֪������þΪ0.2mol����������Ϊ0.3mol-0.2mol=0.1mol�������غ����Mg2+��Al3+���ʵ���Ũ��֮�ȣ�
��C������������ǡ�ñ��ܽ�Ϊƫ�����ƣ���ʱ����Ϊ������þ�����ݷ���ʽ����ݷ���ʽ����OA�Ρ�AB������NaOH���ʵ����������������NaOH���ʵ�����
�ܸ��ݢ��м����֪OA�Ρ�AB������NaOH���ʵ���֮�ȣ�
��� �⣺��1����ת����ϵ��֪���ɰ�ɫ����E�ڿ�����ת��Ϊ���ɫ����F����EΪFe��OH��2��FΪFe��OH��3����ҺD����������Һ�õ���ɫ����H��������Һ��ɫ��ӦΪ��ɫ���ʺ���K+����ɫ����HΪAgCl����DΪKCl������ҺC+��ҺB��KCl+Fe��OH��2��ΪFeCl2��KOH�ķ�Ӧ��Fe��OH��3�����ᷴӦ�õ�G��G��A��Ӧ�õ�B����֪BΪFeCl2��CΪKOH��GΪFeCl3��AΪFe��
��������������֪��BΪKOH��DΪKCl���ʴ�Ϊ��KOH��KCl��
����Eת���F�Ļ�ѧ����ʽΪ��4Fe��OH��2+2H2O+O2=4Fe��OH��3���ʴ�Ϊ��4Fe��OH��2+2H2O+O2=4Fe��OH��3��
����KSCN����FeCl3������Һ��ΪѪ��ɫ����FeCl3��Һ����Fe���й����ӷ�Ӧ����ʽ��Fe+2Fe3+=3Fe2+���ʴ�Ϊ����Һ��ΪѪ��ɫ��Fe+2Fe3+=3Fe2+��
��2�����Ȼ�þ���Ȼ��������Ժ��������Ʒ�����Ӧ�����ɳ���������þ��������������OD�η�����Ӧ�����ӷ���ʽAl3++3OH-=Al��OH��3����Mg2++2OH-=Mg��OH��2����
DC���������������������Ʒ�Ӧ����ƫ��������ˮ����Ӧ���ӷ���ʽΪAl��OH��3+OH-=AlO2-+2H2O��
�ʴ�Ϊ��Al3++3OH-=Al��OH��3����Mg2++2OH-=Mg��OH��2����Al��OH��3+OH-=AlO2-+2H2O��
����ͼ��֪�����������Ϊ0.3mol����������СΪ0.2mol����֪������þΪ0.2mol����������Ϊ0.3mol-0.2mol=0.1mol�������غ��֪Mg2+��Al3+���ʵ���Ũ��֮��Ϊ0.2mol��0.1mol=2��1��
�ʴ�Ϊ��2��1��
��C������������ǡ�ñ��ܽ�Ϊƫ�����ƣ���ʱ����Ϊ������þ��Al3+�Ѿ�ת��ΪAlO2-��Mg2+�Ѿ�ת��ΪMg��OH��2��
������þΪ0.2mol����������Ϊ0.3mol-0.2mol=0.1mol����Al3++3OH-=Al��OH��3����Mg2++2OH-=Mg��OH��2������֪OA������NaOHΪ0.1mol��3+0.2mol��2=0.7mol����Al��OH��3+OH-=AlO2-+2H2O��֪��AB������NaOHΪ0.1mol����C�����NaOHΪ0.7mol+0.1mol=0.8mol��
�ʴ�Ϊ��0.8��AlO2-��Mg��OH��2��
�ܸ��ݢ��м����֪OA�Ρ�AB������NaOH���ʵ���֮��0.7mol��0.1mol=7��1���ʴ�Ϊ��7��1��
���� ���⿼�������ƶϡ�������йؼ��㣬����ƴ������Ŀ����1����������ɫ����ɫ��ӦΪ�ƶ�ͻ�ƿڣ���2���йؼ�����ȷ���η����ķ�Ӧ���Ѷ��еȣ�

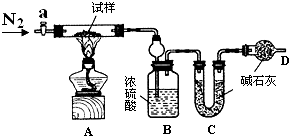 С�մ�NaHCO3�������к���̼���ƾ��壨Na2CO3•10H2O����Ϊ�ⶨ������С�մ����������w��NaHCO3����ʵ��С��ͬѧ���������װ�ý���ʵ�飮
С�մ�NaHCO3�������к���̼���ƾ��壨Na2CO3•10H2O����Ϊ�ⶨ������С�մ����������w��NaHCO3����ʵ��С��ͬѧ���������װ�ý���ʵ�飮ʵ����̣�
��ͼ��װ���������װ�õ������ԣ�
������m1g����Ӳ�ʲ������У�װ��B��C��D��ҩƷ��ͼ����֪��ҩƷ��װ��B������Ϊm2g��װ��C������Ϊm3g��
�رջ���a����ȼ�ƾ��Ƽ���������ֱ��Bװ����������ð������a��װ����ͨ��N2��һ��ʱ������ƾ��ƣ��رջ���a��
�����Ƶ�װ��B������Ϊm4g��װ��C������Ϊm5g��
��ش��������⣨װ����ԭ�п�����ʵ���Ӱ����Բ��ƣ���
��1��װ��A�з�����Ӧ�Ļ�ѧ����ʽΪ2NaHCO3$\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+CO2��+H2O��Na2CO3•10H2O$\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+10H2O��
��2��װ��C������Ϊ���շ�Ӧ���ɵ�ˮ������װ��D������Ϊ���շ�Ӧ���ɵĶ�����̼��
��3��ʵ�������ͨ��N2��Ŀ����ʹװ���еĶ�����̼��ˮ����ȫ���ų���װ��BCȫ�����գ�
��4�������и������ṩ�������ܼ����w��NaHCO3������bce����ѡ����ĸ����
| ��� | a | b | c | d | e |
| ���� | m1��m2��m3 | m2��m3��m4��m5 | m1��m2��m4 | m1��m4��m5 | m1��m2��m5 |
| A�� | SO42-��CO32-��F- | B�� | CO32-��SO42-��F- | C�� | CO32-��F-��SO42- | D�� | F-��CO32-��SO42- |
| A�� | ʵ���ʣ��������ɷŻ�ԭ�Լ�ƿ�� | |
| B�� | �ո��п����Ƶ�����ɫ�����ܿ�䰵 | |
| C�� | ��Ȼ����������̬���ƴ��� | |
| D�� | ���ڿ����м���ʱ���ɰ�ɫ�Ĺ������� |
| A�� | ��ϡ�����м���ͭ�ۣ�ͭ�۲��ܽ⣬�ټ���Cu��NO3��2���壬ͭ���Բ��ܽ� | |
| B�� | ij������ʹʪ��ĺ�ɫʯ����ֽ�������������ˮ��Һһ���Լ��� | |
| C�� | Ũ������ľ̿��Ӧ�����ӷ���ʽ��C+4H++4NO3-=CO2��+4NO2��+2H2O | |
| D�� | HNO3��NO��NO2�����ϸ����仯����ͨ��һ��ʵ�� |
 ��
��