题目内容
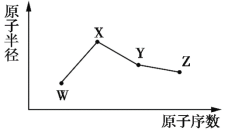
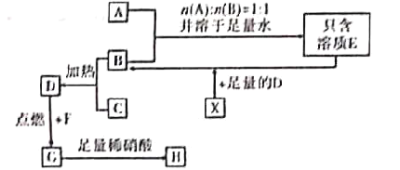
【题目】根据如下框图分析,下列说法正确的是

A.E2+的氧化性比M2+的氧化性强
B.在反应③中若不加稀硫酸可能看到红褐色沉淀
C.反应⑤的离子方程式可表示为E2++3OH-=E(OH)3↓
D.在反应①中只能用浓硫酸,既表现酸性,又表现了氧化性
【答案】B
【解析】
M为红色金属,即Cu,与硫酸反应生成硫酸铜,与金属E反应能置换出Cu,说明E的活泼项性强于Cu,得到的溶液X可被H2O2氧化,生成的Y遇到KSCN能出现红色,说明Y中含有Fe3+,那么X中存在Fe2+,则金属E为Fe,红褐色固体Z为Fe(OH)3,据此进行分析判断。
A. 铁的还原性强于铜,那么Cu2+的氧化氢强于Fe2+,A项错误;
B. 在反应③中若不加稀硫酸,反应为:6Fe2++3H2O2= Fe(OH)3↓+4Fe3+,可以看到红褐色沉淀,B项正确;
C. 反应⑤的离子方程式可表示为Fe3++3NH3H2O=Fe (OH)3↓+3NH4+,C项错误;
D. 在反应①中表现氧化性的是H2O2,硫酸只提供了酸性环境,D项错误;
答案选B。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目