题目内容
10.下列实验能成功的是( )| A. | 将乙酸和乙醇混合加热制乙酸乙酯 | |
| B. | 乙醇、浓硫酸加热到140℃制乙烯 | |
| C. | CH3CH2Br中滴加AgNO3溶液观察是否有浅黄色沉淀,判断卤代烃的类型 | |
| D. | 用CuSO4溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热煮沸观察红色沉淀 |
分析 A.无催化剂无法制得乙酸乙酯;
B.实验室制备乙烯,温度应该控制在170℃;
C.CH3CH2Br没有自由移动的离子;
D.醛类能够与新制的氢氧化铜浊液反应生成红色沉淀.
解答 解:A.乙酸与乙醇发生酯化反应时需要浓硫酸作催化剂,故A错误;
B.将乙醇与浓硫酸共热到170℃制备乙烯,140℃时生成的是乙醚,故B错误;
C.CH3CH2Br没有自由移动的离子,应向CH3CH2Br中先加入氢氧化钠,再加入硝酸酸化的硝酸银以检验溴元素,所以CH3CH2Br中滴加AgNO3溶液观察则不能实现判断卤代烃的类型,故C错误;
D.醛类能够与新制的氢氧化铜浊液反应生成红色沉淀,所以CuSO4溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热可以观察到有红色沉淀产生,故D正确.
故选D.
点评 本题以实验形成考查物质的性质,注意在解此类题时,首先需要知道物质发生反应的条件,熟记各官能团的性质是解题的关键,题目难度不大.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
20.下列各组离子,在所给条件下一定能够大量共存的是( )
| A. | 常温下pH=7的溶液中:Fe3+、Mg2+、NO3-、SO42- | |
| B. | 常温下$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的溶液中:Ca2+、Mg2+、ClO-、I- | |
| C. | 在含有大量HCO3-的溶液中:K+、Na+、AlO2-、Br- | |
| D. | 加入苯酚显紫色的溶液中:Na+、Mg2+、Cl-、SO42- |
1.如图是电解CuCl2溶液的装置,其中c、d为石墨电极.下列说法正确的是( )


| A. | c为正极、d为负极 | |
| B. | 电路中电子的流动方向:b-d-CuCl2溶液-c-a | |
| C. | 电解过程中,d电极质量增加 | |
| D. | 电解过程中,氯离子浓度不变 |
18.砷(As)与其化合物常被运用在农药、除草剂、杀虫剂中.已知它与氮同主族,而与钙同周期,下列关于砷的有关描述中正确的是( )
| A. | 原子序数为23 | |
| B. | 最高价氧化物为As2O3,为酸性氧化物 | |
| C. | 原子半径比钙小 | |
| D. | 气态氢化物分子式为AsH3,稳定性强于NH3 |
5.美国科学家宣布发现了铝的“超级原子”结构--Al13和Al14,已知这类“超级原子”最外层电子数之和为40个时处于相对稳定状态,下列说法中,正确的是( )
| A. | Al13和Al14互为同位素 | |
| B. | Al14与盐酸反应的化学方程式可表示为:Al14+2HCl=Al14Cl2+H2↑ | |
| C. | Al13和Al14都具有较强的还原性,容易失去电子生成阳离子 | |
| D. | Al13超原子中Al原子间通过离子键结合 |
15.由短周期元素形成的化合物有许多组成情况如果化学式为XY2,下列叙述正确的( )
| A. | 如果XY2是共价化合物,则X与Y的原子序数不可能相差1 | |
| B. | 如果X与Y的原子序数相差6,则共价化合物XY2可溶于强碱溶液 | |
| C. | 如果X与Y的原子序数相差5,则离子化合物XY2不溶于水 | |
| D. | 如果XY2是离子化合物,则X与Y的原子序数可能相差9 |
2.下列有关概念或原理的叙述正确的是 ( )
| A. | 氨基酸、蛋白质和氧化铝一样既能与酸反应,又能与碱反应,所以它们都是两性氧化物 | |
| B. | 制造婴儿用的一次性纸尿片采用的吸水保水的材料可以是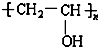 | |
| C. | 乙烯和聚乙烯都能使酸性KMnO4溶液褪色 | |
| D. | 甲酸乙酯、葡萄糖、麦芽糖、淀粉这四种物质的共同性质是,它们既可以发生水解反应,又可以发生银镜反应 |
20.两种短周期的元素X和Y,可组成化合物XY3.当Y的原子序数为m时,X的原子序数可能是:①m-4,②m+4,③m+8,④m-2,⑤m+6,其中正确的组合是( )
| A. | ①② | B. | ①②③ | C. | ①②⑤ | D. | ①②③④⑤ |
 ;取代反应;.
;取代反应;.