题目内容
11.下列措施可以降低化学反应速率的是( )| A. | 生活中,用冰箱保存食物 | |
| B. | H2O2分解时,用MnO2 作催化剂 | |
| C. | 工业合成氨时,采用高温高压的措施 | |
| D. | 提高反应物的浓度 |
分析 响化学反应的因素很多,温度、浓度、压强、催化剂以及固体的接触面积对反应速率都有影响,据此分析.
解答 解:A、将食物贮藏在冰箱中,温度降低,能减慢反应速率.故A正确;
B、二氧化锰粉末作催化剂,能加快过氧化氢溶液制氧气的反应速率,故B错误;
C、升温,加压化学反应速率加快,故C错误;
D、提高反应物浓度反应速率加快,故D错误;
故选A.
点评 本题考查影响化学反应速率的因素.温度、催化剂、固体的接触面积都能影响化学反应速率.

练习册系列答案
相关题目
1.以下化学用语正确的是( )
| A. | 熟石膏的化学式:2CaSO4•H2O | B. | 明矾的化学式KAlSO4•12H2O | ||
| C. | CaCl2的电子式: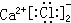 | D. | 氯化钠的电子式Na:$\underset{\stackrel{..}{Cl}}{..}$: |
2.提出了核外电子分层排布的原子结构模型的科学家是( )
| A. | 卢瑟福 | B. | 玻尔 | C. | 汤姆逊 | D. | 道尔顿 |
19.用惰性电极电解下列溶液一段时间后,再加入一定量的某种物质(括号内物质),能够使溶液恢复到原来的成分和浓度的是( )
| A. | AgNO3(AgNO3) | B. | NaOH(NaOH) | C. | KCl(KCl) | D. | CuSO4(CuO) |
6.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下面是八种短周期元素的相关信息(已知铍的原子半径为0.089nm)
F原子中无中子,G最高正价数与负价数相等,且最外层电子数是次外层的二倍,H元素单质焰色反应呈黄色.
(1)B元素在元素周期表中的位置第三周期第ⅢA族B形成的简单离子的结构示意图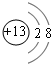 .
.
(2)上述元素的最高价氧化物对应的水化物中酸性最强的是H2SO4.
(3)用电子式表示C、H形成化合物的过程: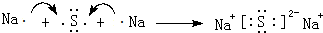 .
.
(4)H、E形成原子个数比为1:1的化合物中所含化学键类型为离子键和非极性键.
(5)G的最高价与E形成的化合物的电子式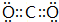 ,该分子的结构式为O=C=O.
,该分子的结构式为O=C=O.
(6)A、B、C、E原子半径由大到小的顺序为Mg>Al>S>O.
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
(1)B元素在元素周期表中的位置第三周期第ⅢA族B形成的简单离子的结构示意图
 .
.(2)上述元素的最高价氧化物对应的水化物中酸性最强的是H2SO4.
(3)用电子式表示C、H形成化合物的过程:
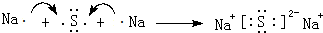 .
.(4)H、E形成原子个数比为1:1的化合物中所含化学键类型为离子键和非极性键.
(5)G的最高价与E形成的化合物的电子式
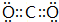 ,该分子的结构式为O=C=O.
,该分子的结构式为O=C=O.(6)A、B、C、E原子半径由大到小的顺序为Mg>Al>S>O.
16.废电池必须进行集中处理的首要原因是( )
| A. | 防止电池中汞、镉和铅等重金属离子污染土壤和水源 | |
| B. | 回收利用石墨电极和金属材料 | |
| C. | 充电后可再使用 | |
| D. | 防止电池中的电解质溶液腐蚀其他物品 |
3.下列属于天然高分子化合物的是( )
| A. | 聚乙烯 | B. | 硝化纤维 | C. | 淀粉 | D. | 油脂 |
10.在100mL混合液中,HNO3和H2SO4物质的量浓度分别是0.4mol/L和0.1mol/L,向该混合液中加入1.92gCu粉,加热充分反应后,所得气体在标况下的体积约为( )
| A. | 0.336L | B. | 0.448L | C. | 0.896 L | D. | 1.344L |
 以H2为燃料的新型燃料电池,电池的工作示意图所示.若此电池以KOH为电解质溶液,试回答下列问题:
以H2为燃料的新型燃料电池,电池的工作示意图所示.若此电池以KOH为电解质溶液,试回答下列问题: