题目内容
20. 以H2为燃料的新型燃料电池,电池的工作示意图所示.若此电池以KOH为电解质溶液,试回答下列问题:
以H2为燃料的新型燃料电池,电池的工作示意图所示.若此电池以KOH为电解质溶液,试回答下列问题:(1)a电极上反应的离子方程式为:2H2+4OH--4e-=4H2O;
(2)该电池的总反应方程式为:2H2+O2=2H2O;
(3)若电池工作过程中,共消耗了5.6L标准状况下的O2,不考虑内外电路中的消耗,则外电路流过电子有NA个.
分析 反应总方程式为2H2+O2=2H2O,可知反应中氢气失电子被氧化,应在负极上的反应,氧气得电子被还原,应在正极上的反应,根据得失电子及反应类型写出相应的电极反应式,结合电极方程式计算.
解答 解:(1)a通入燃料,被氧化,应为负极,电极方程式为2H2+4OH--4e-=4H2O,故答案为:2H2+4OH--4e-=4H2O;
(2)氢气与氧气反应生成水,总反应式为2H2+O2=2H2O,故答案为:2H2+O2=2H2O;
(3)正极反应为O2+2H2O+4e-=4OH-,共消耗了5.6L标准状况下的O2,n(O2)=$\frac{5.6L}{22.4L/mol}$=0.25mol,则转移电子1mol,个数为NA,故答案为:NA.
点评 本题考查了原电池原理和电极反应式的书写,为高频考点,侧重于学生的分析能力的考查,难度不大,要注意的是写电极反应式要结合电解质溶液,如果电解质溶液不同.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
10.草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
[查阅资料]KMnO4溶液氧化H2C2O4的反应历程为:
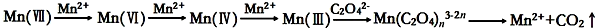
[提出假设]
假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是反应物浓度降低,反应速率减慢.
[设计、完成实验]
(1)称取6.3g草酸晶体(H2C2O4•2H2O),配制500mL0.10mol/L H2C2O4溶液.
①在上述过程中必须用到的2种定量仪器是托盘天平和500mL容量瓶.
②下列操作会使所配溶液浓度偏低的是AD(填下列选项的字母序号).
A.称取草酸晶体时,将草酸晶体放在托盘天平右盘
B.定容时俯视刻度线
C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容
(2)完成探究,记录数据
x=25时,假设2成立.
(3)由于KMnO4能氧化水中有机物等因素,为配制好稳定的KMnO4溶液,其浓度需标定.取10.00mL 0.10mol/L H2C2O4溶液于锥形瓶中,加入10mL 0.50mol/L稀硫酸,用(2)中KMnO4溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00mL,则草酸溶液与酸性KMnO4溶液反应的离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.上述实验中KMnO4溶液的物质的量浓度为0.010mol/L.
[查阅资料]KMnO4溶液氧化H2C2O4的反应历程为:
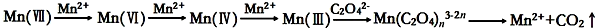
[提出假设]
假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是反应物浓度降低,反应速率减慢.
[设计、完成实验]
(1)称取6.3g草酸晶体(H2C2O4•2H2O),配制500mL0.10mol/L H2C2O4溶液.
①在上述过程中必须用到的2种定量仪器是托盘天平和500mL容量瓶.
②下列操作会使所配溶液浓度偏低的是AD(填下列选项的字母序号).
A.称取草酸晶体时,将草酸晶体放在托盘天平右盘
B.定容时俯视刻度线
C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容
(2)完成探究,记录数据
| 实验编号 | 烧杯中所加试剂及用量(mL) | 控制 条件 | 溶液褪色时间(S) | |||
| 0.10mol/LH2C2O4 溶液 | 等浓度 KMnO4溶液 | H2O | 0.50mol/L 稀硫酸 | |||
| 1 | 30 | 20 | 30 | 20 | 18 | |
| 2 | 30 | 20 | 30 | 20 | 水浴控制温度65° | 15 |
| 3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
| 4 | 30 | 20 | x | 20 | 加入5mL0.10mol/LK2SO4 | 18 |
(3)由于KMnO4能氧化水中有机物等因素,为配制好稳定的KMnO4溶液,其浓度需标定.取10.00mL 0.10mol/L H2C2O4溶液于锥形瓶中,加入10mL 0.50mol/L稀硫酸,用(2)中KMnO4溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00mL,则草酸溶液与酸性KMnO4溶液反应的离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.上述实验中KMnO4溶液的物质的量浓度为0.010mol/L.
11.下列措施可以降低化学反应速率的是( )
| A. | 生活中,用冰箱保存食物 | |
| B. | H2O2分解时,用MnO2 作催化剂 | |
| C. | 工业合成氨时,采用高温高压的措施 | |
| D. | 提高反应物的浓度 |
8.用下图所示装置及药品进行相应实验,能达到实验目的是( )
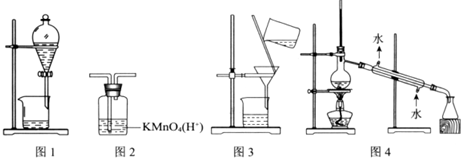

| A. | 图1 分离乙醇和乙酸 | B. | 图2 除去乙炔中的乙烯 | ||
| C. | 图3 除去溴苯中的溴单质 | D. | 图4 除去工业酒精中的甲醇 |
15.下列反应中,即属于氧化还原反应同时又是吸热反应的是( )
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 铝与稀盐酸 | ||
| C. | 灼热的炭与CO2反应 | D. | 氢氧化钠溶液与醋酸溶液 |
12.最近科学界合成一种“二重结构”的球形物质分子,是把足球型的C60分子融进足球型的Si60分子中,外面的Si原子与里面的C原子结合,下列关于这种物质的叙述中正确的是( )
| A. | 是两种单质的混合物 | B. | 是共价化合物 | ||
| C. | 该新物质硬度很大 | D. | 含有离子键 |
9. 已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1×10-12.如图该温度下是向10mL AgNO3溶液中逐渐加入0.1mol•L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论不正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )
已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1×10-12.如图该温度下是向10mL AgNO3溶液中逐渐加入0.1mol•L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论不正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )
 已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1×10-12.如图该温度下是向10mL AgNO3溶液中逐渐加入0.1mol•L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论不正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )
已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1×10-12.如图该温度下是向10mL AgNO3溶液中逐渐加入0.1mol•L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论不正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )| A. | 原AgNO3溶液的物质的量浓度为1mol•L-1 | |
| B. | 图中x点的坐标为(100,6) | |
| C. | 若升高温度,图象会发生变化 | |
| D. | 把0.1mol•L-1的NaCl换成0.1mol•L-1 NaI则图象在终点后变为虚线部分 |
19.下列有机化学反应方程式正确的是( )
| A. | 2-丙醇的催化氧化:2CH3CH(OH)CH3+O2$→_{△}^{Cu}$2CH3CH2CHO+2H2O | |
| B. | 用新制的Cu(OH)2悬浊液检验乙醛:CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O | |
| C. | 实验室制取酚醛树脂: | |
| D. | 甲醛溶液与足量的银氨溶液共热:HCHO+2[Ag(NH3)2]OH$\stackrel{△}{→}$HCOONH4+2Ag↓+3NH3+H2O |
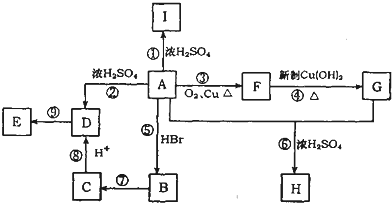
 .
. ;写出反应⑦的化学方程式:
;写出反应⑦的化学方程式: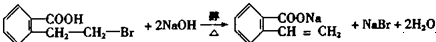 .
.