题目内容
1.以下化学用语正确的是( )| A. | 熟石膏的化学式:2CaSO4•H2O | B. | 明矾的化学式KAlSO4•12H2O | ||
| C. | CaCl2的电子式: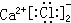 | D. | 氯化钠的电子式Na:$\underset{\stackrel{..}{Cl}}{..}$: |
分析 A.石膏[CaSO4•2H2O]加热到150~170℃时,会失去部分结晶水而生成熟石膏[2CaSO4•H2O];
B.明矾的化学式中含有两个硫酸根离子;
C.氯化钙的电子式中,两个氯离子不能合并;
D.氯化钠为离子化合物,其电子式中需要标出阴阳离子所带电荷.
解答 解:A.CaSO4•2H2O生石膏,生石膏加热可以转化成熟石膏:2CaSO4•H2O,故A正确;
B.明矾为化合物,其阴阳离子的正电荷应该为0,明矾正确的化学式为:KAl(SO4)2•12H2O,故B错误;
C.氯化钙为离子化合物,电子式中需要标出阴阳离子所带电荷,氯化钙的电子式为: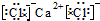 ,故C错误;
,故C错误;
D.氯化钠为离子化合物,钠离子直接用离子符号表示,氯离子需要标出最外层电子及所带电荷,正确的电子式为: ,故D错误;
,故D错误;
故选A.
点评 本题考查了常见化学用语的判断,题目浓度中等,注意掌握常见物质的名称、化学式与俗名的关系,明确常见化学用语的书写原则,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列有机物中,所有原子可能处于同一平面的是( )
| A. | 乙烷 | B. | 甲苯 | C. | 丙炔 | D. | 苯乙烯 |
12. 运动员服用兴奋剂是违背人文道德的.某种兴奋剂的结构简式如下图所示,有关该物质的说法错误的是( )
运动员服用兴奋剂是违背人文道德的.某种兴奋剂的结构简式如下图所示,有关该物质的说法错误的是( )
 运动员服用兴奋剂是违背人文道德的.某种兴奋剂的结构简式如下图所示,有关该物质的说法错误的是( )
运动员服用兴奋剂是违背人文道德的.某种兴奋剂的结构简式如下图所示,有关该物质的说法错误的是( )| A. | 滴入KMnO4(H+)溶液,观察到紫色褪去 | |
| B. | 该分子中的所有碳原子可能共平面 | |
| C. | 1 mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为4 mol、7 mol | |
| D. | 遇FeCl3溶液不显颜色 |
9.有机物X由C、H、O三种元素组成,相对分子质量为90,分子中含有3个氧原子,能与NaHCO3溶液反应生成CO2.在浓硫酸作用下,2分子A之间脱水可生成六元环化合物.有关X的说法正确的是( )
| A. | 分子式是C3H8O3 | |
| B. | A催化氧化的产物能发生银镜反应 | |
| C. | 0.1 mol A与足量Na反应产生2.24 L H2(标准状况) | |
| D. | A在一定条件下发生缩聚反应的产物是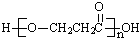 |
16.下列有机物符合最简式为CH2的是( )
| A. | C3H8 | B. | C2H6 | C. | CH4 | D. | C4H8 |
10.草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
[查阅资料]KMnO4溶液氧化H2C2O4的反应历程为:
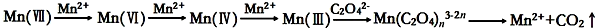
[提出假设]
假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是反应物浓度降低,反应速率减慢.
[设计、完成实验]
(1)称取6.3g草酸晶体(H2C2O4•2H2O),配制500mL0.10mol/L H2C2O4溶液.
①在上述过程中必须用到的2种定量仪器是托盘天平和500mL容量瓶.
②下列操作会使所配溶液浓度偏低的是AD(填下列选项的字母序号).
A.称取草酸晶体时,将草酸晶体放在托盘天平右盘
B.定容时俯视刻度线
C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容
(2)完成探究,记录数据
x=25时,假设2成立.
(3)由于KMnO4能氧化水中有机物等因素,为配制好稳定的KMnO4溶液,其浓度需标定.取10.00mL 0.10mol/L H2C2O4溶液于锥形瓶中,加入10mL 0.50mol/L稀硫酸,用(2)中KMnO4溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00mL,则草酸溶液与酸性KMnO4溶液反应的离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.上述实验中KMnO4溶液的物质的量浓度为0.010mol/L.
[查阅资料]KMnO4溶液氧化H2C2O4的反应历程为:
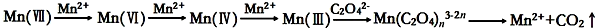
[提出假设]
假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是反应物浓度降低,反应速率减慢.
[设计、完成实验]
(1)称取6.3g草酸晶体(H2C2O4•2H2O),配制500mL0.10mol/L H2C2O4溶液.
①在上述过程中必须用到的2种定量仪器是托盘天平和500mL容量瓶.
②下列操作会使所配溶液浓度偏低的是AD(填下列选项的字母序号).
A.称取草酸晶体时,将草酸晶体放在托盘天平右盘
B.定容时俯视刻度线
C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容
(2)完成探究,记录数据
| 实验编号 | 烧杯中所加试剂及用量(mL) | 控制 条件 | 溶液褪色时间(S) | |||
| 0.10mol/LH2C2O4 溶液 | 等浓度 KMnO4溶液 | H2O | 0.50mol/L 稀硫酸 | |||
| 1 | 30 | 20 | 30 | 20 | 18 | |
| 2 | 30 | 20 | 30 | 20 | 水浴控制温度65° | 15 |
| 3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
| 4 | 30 | 20 | x | 20 | 加入5mL0.10mol/LK2SO4 | 18 |
(3)由于KMnO4能氧化水中有机物等因素,为配制好稳定的KMnO4溶液,其浓度需标定.取10.00mL 0.10mol/L H2C2O4溶液于锥形瓶中,加入10mL 0.50mol/L稀硫酸,用(2)中KMnO4溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00mL,则草酸溶液与酸性KMnO4溶液反应的离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.上述实验中KMnO4溶液的物质的量浓度为0.010mol/L.
11.下列措施可以降低化学反应速率的是( )
| A. | 生活中,用冰箱保存食物 | |
| B. | H2O2分解时,用MnO2 作催化剂 | |
| C. | 工业合成氨时,采用高温高压的措施 | |
| D. | 提高反应物的浓度 |
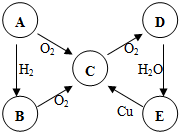 ABCDE五种物质中含有同一种元素,其相互转化关系如图所示.如果A是淡黄色固体:(以下均写化学式)
ABCDE五种物质中含有同一种元素,其相互转化关系如图所示.如果A是淡黄色固体:(以下均写化学式) B→C的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
B→C的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.