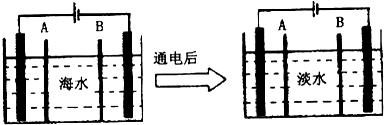
题目内容
17.将0.1mol N2和0.3mol H2置于密闭容器中发生反应:N2+3H2$?_{催化剂}^{高温、高压}$2NH3,下列关于该反应的说法中正确的是( )| A. | 增大压强,反应速率减小 | |
| B. | 最终可生成0.2 mol NH3 | |
| C. | 升髙温度,反应速率增大 | |
| D. | 当V正(N2):V 正(H2)=1:3时,一定达化学平衡状态 |
分析 A、增大压强反应速率增大,正逆反应速率都增大;
B、反应是可逆反应不能进行彻底;
C、升温,正逆反应速率都增大;
D、任何化学反应中正反应速率之比等于化学计量数之比.
解答 解:A、增大压强反应速率增大,正逆反应速率都增大,故A错误;
B、反应是可逆反应不能进行彻底,将0.1mol N2和0.3mol H2置于密闭容器中发生反应N2+3H2?2NH3.生成的氨气物质的量一定小于0.2mol,故B错误;
C、升温增大反应速率,正逆反应速率都增大,吸热方向速率增大的大,故C正确;
D、反应速率之比等于化学方程式计量数之比,反应过程中和化学平衡状态都符合,不能说明反应达到平衡状态,故D错误;
故选C.
点评 本题考查了化学平衡影响因素分析,化学平衡移动原理的应用,掌握原理应用是关键,题目较简单.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
14.下列化学用语正确的是( )
| A. | 硫的原子结构示意图: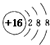 | |
| B. | NH4Br的电子式: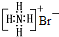 | |
| C. | Be2+离子中的质子数和电子数之比为2:1 | |
| D. | 中子数为146、原子序数为92的铀(U)原子:${\;}_{92}^{146}$U |
8.下列有关化学与自然资源的开发利用描述中错误的是( )
| A. | 用H2作为燃料的优点之一是燃烧后的产物不污染环境 | |
| B. | 要使海水淡化通常有蒸馏法和离子交换法 | |
| C. | 冶炼金属铝通常用电解氯化铝的方法 | |
| D. | 煤的干馏属于化学变化 |
5.下列说法正确的是( )
| A. | 某烷烃的结构为: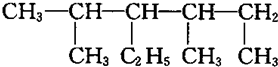 ,正确的命名是3,5-二甲基-4-乙基己烷 ,正确的命名是3,5-二甲基-4-乙基己烷 | |
| B. | 涤纶是由对苯二甲酸(PTA)和乙二醇(EG)通过加聚反应得到的 | |
| C. | 有机物CH3CH2CH(CH3)2的一氯代物有4种 | |
| D. | 有机同系物具有相同的通式,且组成相差若干个“CH2”,因此等质量的同系物燃烧耗氧相差物质的量为1.5nmol |
2. 某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断正确的是( )
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断正确的是( )
 某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断正确的是( )
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断正确的是( )| A. | Ksp[Fe(OH)3]<Ksp[Cu(OH)2] | |
| B. | 加适量NH4Cl固体可使溶液由a点变到b点 | |
| C. | 对a、b两点的Ksp前者大于后者 | |
| D. | Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和 |
9.下列有关化工生产的说法中不正确的是( )
| A. | 工业上用电解熔融的氯化物的方法制备金属镁和铝 | |
| B. | 适当提高合成氨原料气中N2的含量,可提高H2的转化率 | |
| C. | 从安全运输上看,硫酸厂靠近硫酸消费中心比靠近原料产地更为有利 | |
| D. | 利用反应NaCl(饱和)+CO2+NH3+H2O=NH4Cl+NaHCO3↓制取NaHCO3时,应在NaCl饱和溶液中先通入过量CO2再通入过量的NH3 | |
| E. | 硫酸厂生产时常采有高压条件提高SO2的转化率 |
6.短周期主族元素X,Y,Z在周期表中的位置如表.下列说法正确的是( )
| Z | |
| X | Y |
| A. | 若它们的原子最外层电子数之和为11,则X为金属元素 | |
| B. | 三种元素原子半径由大到小的顺序一定是Y>X>Z | |
| C. | 若它们均为金属元素,则Y的最高价氧化物对应水化物的碱性最强 | |
| D. | Z元素的最高化合价一定大于X元素 |
7.150ml 1mol/L的NaOH溶液吸收了2.24L CO2(标准状况下)则下列说法正确的是( )
| A. | HCO3-离子略多于CO32-离子 | |
| B. | HCO3-离子等于CO32-离子 | |
| C. | HCO3-离子略少于CO32-离子 | |
| D. | Na+离子数等于HCO3-和CO32-离子数之和 |