题目内容
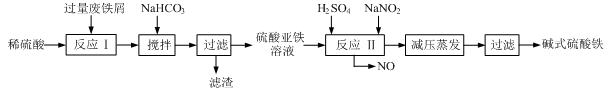
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
(1)加入过量废铁屑的目的是 ,此时溶液中存在的阳离子主要有 ,用NaHCO3调整溶液pH时的离子方程式是 。
(2)在实际生产中,反应Ⅱ中常同时通入O2以减少NaNO2的用量,同时通入O2的作用是 。
(3)碱式硫酸铁溶于水后能电离产生[Fe(OH)]2+离子,写出[Fe(OH)]2+发生水解反应生成Fe(OH)3的离子方程式 。
(4)已知废铁屑中铁元素的质量分数为84.0%,若不考虑每步反应中铁元素的损耗,现有100吨废铁屑理论上最多能生产 吨碱式硫酸铁。

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入过量废铁屑的目的是 ,此时溶液中存在的阳离子主要有 ,用NaHCO3调整溶液pH时的离子方程式是 。
(2)在实际生产中,反应Ⅱ中常同时通入O2以减少NaNO2的用量,同时通入O2的作用是 。
(3)碱式硫酸铁溶于水后能电离产生[Fe(OH)]2+离子,写出[Fe(OH)]2+发生水解反应生成Fe(OH)3的离子方程式 。
(4)已知废铁屑中铁元素的质量分数为84.0%,若不考虑每步反应中铁元素的损耗,现有100吨废铁屑理论上最多能生产 吨碱式硫酸铁。
(1)使硫酸充分反应掉、提高硫酸利用率或使Fe3+尽可能转化为Fe2+(2分,答对一点即可得2分,其它合理答案也可) Fe2 +、Al3+(2分); 3HCO3-+Al3+ =3CO2↑ + Al(OH)3↓ (2分)
(2)作氧化剂并且可减少污染性气体的排放(其他合理答案也可,1分)
(3)[Fe(OH)]2++2H2O Fe(OH)3 + 2H+ (2分)
Fe(OH)3 + 2H+ (2分)
(4)253.5 (2分)
(2)作氧化剂并且可减少污染性气体的排放(其他合理答案也可,1分)
(3)[Fe(OH)]2++2H2O
 Fe(OH)3 + 2H+ (2分)
Fe(OH)3 + 2H+ (2分)(4)253.5 (2分)
试题分析:(1)把废铁屑加入稀硫酸中,所以其作用为:使硫酸充分反应掉或提高硫酸利用率或使Fe3+尽可能转化为Fe2+;废铁屑还含有Al2O3,所以与H2SO4反应后的溶液含Fe2 +、Al3+;加入NaHCO3后与Al3+发生相互促进的水解反应:3HCO3-+Al3+ =3CO2↑ + Al(OH)3↓。
(2)NaNO2氧化Fe2+会生成NO,造成污染,而O2氧化Fe2+产物无污染,所以O2的作用为:作氧化剂并且可减少污染性气体的排放。
(3)[Fe(OH)]2+结合H2O电离的OH?生成Fe(OH)3,离子方程式为:[Fe(OH)]2++2H2O
 Fe(OH)3 + 2H+
Fe(OH)3 + 2H+(4)根据Fe元素守恒可知:Fe ~ Fe(OH)SO4 100吨废铁屑理论上可生成碱式硫酸铁的质量为:100×84.0%÷56×169=253.5吨。

练习册系列答案
相关题目


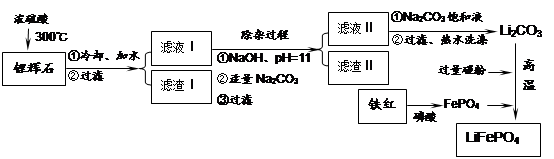
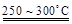 Li2SO4 + Al2O3·4SiO2·H2O↓
Li2SO4 + Al2O3·4SiO2·H2O↓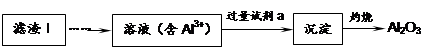
 LiFePO4,电池中的固体电解质可传导Li+。试写出该电池放电时的正极反应: 。若用该电池电解饱和食盐水(电解池电极均为惰性电极),当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为 。
LiFePO4,电池中的固体电解质可传导Li+。试写出该电池放电时的正极反应: 。若用该电池电解饱和食盐水(电解池电极均为惰性电极),当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为 。