题目内容
【题目】用如图所示实验装置进行SO2性质的探究实验. 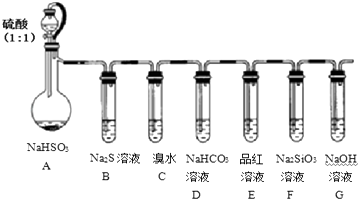
(1)装置A中发生反应的离子方程式为: , G装置的作用 .
(2)简述检查该装置气密性的方法 .
(3)能够证明SO2具有还原性、氧化性的实验装置依次为和(用字母表示),观察到的现象依次是、 .
(4)若要证明酸性:H2CO3>H2SiO3 , 则应观察到的实验现象有 .
(5)某同学用32gCu与50g 98%浓硫酸反应来制取SO2 , 实验结束后,还有19.2g的Cu剩余,若要让Cu完全溶解,则至少应加入1mol/L的稀硝酸mL.
【答案】
(1)HSO3﹣+H+=SO2↑+H2O|吸收尾气;可防止空气中二氧化碳进入F中
(2)G中加水至没过导气管口;微溶A中的圆底烧瓶;若G中有气泡产生;停止加热;冷却后导管末端形成一段水柱;说明气密性良好
(3)C和B|C中溴水褪色|B中出现黄色沉淀
(4)E中品红不褪色;F中出现白色浑浊
(5)600
【解析】解:浓硫酸与亚硫酸钠反应生成二氧化硫,二氧化硫与硫化钠发生氧化还原反应生成硫,二氧化硫表面氧化性,二氧化硫与溴水反应生成氢溴酸和硫酸,二氧化硫溶液呈酸性,与碳酸氢钠溶液反应生成二氧化碳气体,二氧化硫具有漂白性,能够使品红溶液褪色,二氧化碳对应的水溶液酸性都比硅酸强,则F中生成硅酸沉淀,二氧化硫有毒,不能直接排放到空气中,能够与氢氧化钠反应生成亚硫酸钠,可以用氢氧化钠吸收过量的二氧化硫,(1)装置A中发生反应的离子方程式为HSO3﹣+H+=SO2↑+H2O,F用于检验二氧化碳与硅酸钠的反应,G可防止空气中二氧化碳进入F中,且可起到吸收尾气的作用,所以答案是:HSO3﹣+H+=SO2↑+H2O;吸收尾气,可防止空气中二氧化碳进入F中;(2)检查气密性,可将G中加水至没过导气管口,微溶A中的圆底烧瓶,若G中有气泡产生,停止加热,冷却后导管末端形成一段水柱,说明气密性良好,
所以答案是:G中加水至没过导气管口,微溶A中的圆底烧瓶,若G中有气泡产生,停止加热,冷却后导管末端形成一段水柱,说明气密性良好;(3)二氧化硫具有还原性,可与溴水发生氧化还原反应而使溴水褪色,同时二氧化硫具有氧化性,可与硫化钠发生氧化还原反应生成硫,溶液变浑浊,
所以答案是:C和B;C中溴水褪色,B中出现黄色沉淀;(4)若要证明酸性:H2CO3>H2SiO3,先排除二氧化硫的干扰,则E中品红不褪色,F中出现白色浑浊,所以答案是:E中品红不褪色,F中出现白色浑浊;(5)铜和浓硫酸发生Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O,实验结束后,还有19.2g的Cu剩余,说明反应的铜的质量为32g﹣19.2g=12.8g,为0.2mol,由方程式可知消耗0.4mol,而50g 98%浓硫酸中n(H2SO4)=0.5mol,则反应后剩余0.1mol硫酸,
CuSO4+SO2↑+2H2O,实验结束后,还有19.2g的Cu剩余,说明反应的铜的质量为32g﹣19.2g=12.8g,为0.2mol,由方程式可知消耗0.4mol,而50g 98%浓硫酸中n(H2SO4)=0.5mol,则反应后剩余0.1mol硫酸,
Cu与稀硝酸反应生成硝酸铜、NO与水,反应离子方程式为:3Cu+2NO3﹣+8H+=3Cu2++2NO+4H2O,n(Cu)= ![]() =0.3mol,由离子方程式可知需要0.8molH+,则需要0.6mol硝酸,体积为600mL,
=0.3mol,由离子方程式可知需要0.8molH+,则需要0.6mol硝酸,体积为600mL,
所以答案是:600.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】一定温度下,向2L恒容容器中充入1molA和1molB,发生反应A(g)+B(g)=C(g)经过一段时间后达到平衡,反应过程中测定的部分数据如表.下对说法正确的是( )
t/s | 0 | 5 | 15 | 25 | 35 | |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.前 5 s 的平均反应速率v(A)=0.03 molL﹣1s﹣1
B.正反应是吸热反应
C.保持温度不变,起始时向容器中充入2molC,达平衡时,C的转化率大于80%
D.保持温度不变,起始时向容器中充入0.2molA,0.2molB和1molC,反应达到平衡前v(正)<v(逆)
