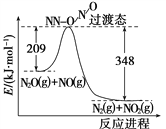
题目内容
【题目】如表为元素周期表的一部分,请参照元素①﹣⑧在表中的位置,用化学用语回答下列问题: 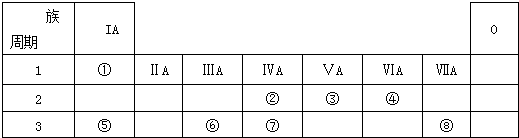
(1)④、⑤、⑥的原子半径由大到小的顺序为 .
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: .
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号) .
a.MnO2b.FeCl3c.Na2SO3d.KMnO4
(5)由表中元素形成的常见物质X,Y,Z,M,N可发生以下反应: 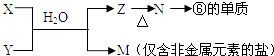
X溶液与Y溶液反应的离子方程式为 , N→⑥的单质的化学方程式为 .
【答案】
(1)Na>Al>O
(2)HNO3>H2CO3>H2SiO3
(3)![]()
(4)ab
(5)Al3++3NH3+3H2O=Al(OH)3↓+3NH4+;2Al2O3  4Al+3O2↑
4Al+3O2↑
【解析】解:由元素在周期表中的位置、可知①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl.
(1.)电子层越多半径越大,所以Na、Al>O,电子层一样多的原子,核电荷数越多半径越小,即Na>Al,所以答案是:Na>Al>O;
(2.)②③是C、N,是同一周期元素的原子,根据元素周期律:从左到右最高价氧化物对应水化物的酸性逐渐增强,所以酸性:HNO3>H2CO3 , ②⑦是C、Si,是同主族元素,根据元素周期律:从上到下最高价氧化物对应水化物的酸性逐渐减弱,H2CO3>H2SiO3 , 所以答案是:HNO3>H2CO3>H2SiO3;
(3.)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,符合条件的有NaOH、NaClO、NaClO3等,NaOH的电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;
;
(4.)两种元素的原子按1:1组成的常见液态化合物为H2O2 , 在MnO2或FeCl3催化作用下分解,而Na2SO3具有还原性,与H2O2发生氧化还原反应,不能用作催化剂,高锰酸钾具有强氧化性,与H2O2发生氧化还原反应,也不能作催化剂,
所以答案是:ab;
(5.)由表中元素形成的常见物质X、Y、Z、M、N可发生如图转化的反应,其中M是仅含非金属的盐,所以一定是铵盐;Z ![]() N→⑥的单质;根据周期表的结构判断⑥是金属铝,所以推断N是氧化铝电解生成金属铝,Z是氢氧化铝受热分解生成氧化铝,由产物及X+Y+H2O→Al(OH)3+NH4+可知该反应是铝盐和一水合氨的反应,所以X溶液与Y溶液反应的离子方程式为Al3++3NH3+3H2O=Al(OH)3↓+3NH4+ , N→⑥的单质的化学方程式为2Al2O3
N→⑥的单质;根据周期表的结构判断⑥是金属铝,所以推断N是氧化铝电解生成金属铝,Z是氢氧化铝受热分解生成氧化铝,由产物及X+Y+H2O→Al(OH)3+NH4+可知该反应是铝盐和一水合氨的反应,所以X溶液与Y溶液反应的离子方程式为Al3++3NH3+3H2O=Al(OH)3↓+3NH4+ , N→⑥的单质的化学方程式为2Al2O3  4Al+3O2↑,
4Al+3O2↑,
所以答案是:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+;2Al2O3  4Al+3O2↑.
4Al+3O2↑.

【题目】某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的离子方程式有:;
(2)硫酸铜溶液可以加快氢气生成速率的原因是;
(3)要加快上述实验中气体产生的速率,还可采取的措施有(答两种);
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
实验 | A | B | C | D | E | F |
4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V3= , V8=;
②反应一段时间后,实验A中的金属呈色,实验E中的金属呈色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因 .
④实验A测得:收集到产生H2体积为112mL(标准状况下)时所需的时间为10分钟,求化学反应速率ν(H2SO4)=(忽略反应前后溶液体积变化).