题目内容
13.下列分子或离子的空间构型为平面三角形的是( )| A. | NO${\;}_{3}^{-}$ | B. | NH3 | C. | H3O+ | D. | CO2 |
分析 根据价层电子对互斥理论确定中心原子杂化方式及粒子的空间构型,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数,立体构型为平面三角形的分子应含有3个σ键,且没有孤对电子,中心原子为sp2杂化,据此分析解答.
解答 解:A.N原子形成3个σ键,孤对电子数=$\frac{5+1-3×2}{2}$,中心原子为sp2杂化,立体构型为平面三角形,故A选;
B.氨气分子中氮原子价层电子对个数=3+$\frac{1}{2}$(5-3×1)=4,且含有一个孤电子对,所以其立体构型是三角锥形,故B不选;
C.O原子形成3个σ键,孤对电子数=$\frac{6-1-1×3}{2}$=1,为sp3杂化,立体构型为三角锥型,故C不选;
D.碳原子形成2个σ键,孤对电子数为=$\frac{4-2×2}{2}$=0,为sp3杂化,二氧化碳立体构型为直线型分子,故D不选;
故选A.
点评 本题考查分子或离子的构型的判断,题目难度中等,注意判断中心原子的价层电子对以及孤对电子数的判断.

练习册系列答案
相关题目
1.关于分散系的下列说法正确的是( )
| A. | 稀豆浆、淀粉溶液、CuSO4溶液均为胶体 | |
| B. | 溶液和胶体的本质区别在于是否能产生丁达尔效应 | |
| C. | NaCl 溶液和BaSO4悬浊液的本质区别是分散质粒子的大小 | |
| D. | 直接加热饱和氯化铁溶液就可以制得氢氧化铁胶体 |
8.已知98%的硫酸物质的量浓度为18.4mol•L-1,则49%的硫酸物质的量浓度是( )
| A. | 小于9.2 mol•L-1 | B. | 等于9.2 mol•L-1 | C. | 大于9.2 mol•L-1 | D. | 不能确定 |
5.砷为第四周期ⅤA族元素,根据它在元素周期表中位置推测,砷不可能具有的性质是( )
| A. | AsH3比NH3稳定 | B. | 可以存在-3、+3、+5等多种化合价 | ||
| C. | As2O5对应水化物的酸性比H3PO4弱 | D. | 砷的氧化性比磷弱 |
2.在一定条件下,将钠与氧气反应的生成物1.4g溶于水,所得溶液恰好能被80 mL浓度为0.50mol•L-1的HCl溶液中和,则该生成物的成分是( )
| A. | Na2O | B. | Na2O2 | C. | Na2O和Na2O2 | D. | 无法判断 |
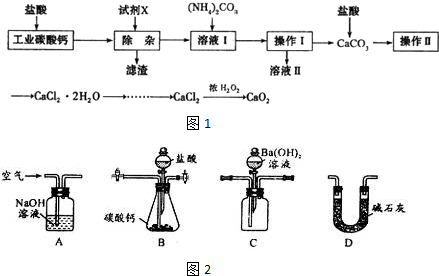


 ,CS2 分子属于非极性分子(填“极性”或“非极性”).写出一种与 CS2互为等电子体的物质的化学式CO2.
,CS2 分子属于非极性分子(填“极性”或“非极性”).写出一种与 CS2互为等电子体的物质的化学式CO2. (1)中国古代四大发明之一--黑火药,它的爆炸反应为S+3C+2KNO3$\frac{\underline{\;点燃\;}}{\;}$K2S+3CO2↑+N2↑.
(1)中国古代四大发明之一--黑火药,它的爆炸反应为S+3C+2KNO3$\frac{\underline{\;点燃\;}}{\;}$K2S+3CO2↑+N2↑.