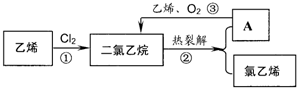
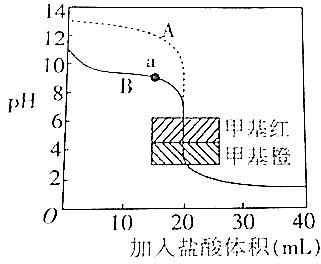
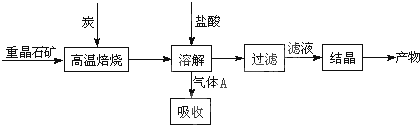
题目内容
1.已知H2S能被下列物质氧化,各物质发生下列变化:Fe3+→Fe2+;Cr2O${\;}_{7}^{2-}$→2Cr3+;Br2→2Br-;HNO3→NO.如果氧化等物质的量的H2S气体得到S单质,需要上述离子或物质的物质的量最小的是( )| A. | Fe3+ | B. | Cr2O${\;}_{7}^{2-}$ | C. | Br2 | D. | HNO3 |
分析 氧化等物质的量的H2S气体得到S单质,转移电子相等.每摩尔离子或物质获得电子越多,则需要离子或物质的物质的量越少.根据化合价变化判断每摩尔离子或物质获得电子的物质的量.据此判断.
解答 解:A.Fe3+→Fe2+,1molFe3+获得电子物质的量为1mol;
B.Cr2O72-→Cr3+,1molCr2O72-获得电子物质的量为1mol×2×(6-3)=6mol;
C.Br2→2Br-,1molBr2获得电子物质的量为1mol×2=2mol;
D.HNO3→NO,1molHNO3获得电子物质的量为1mol×(5-2)=3mol.
所以每摩尔离子或物质获得电子为Fe3+<Br2<HNO3<Cr2O72-.每摩尔离子或物质获得电子越多,则需要离子或物质的物质的量越少,所以需Cr2O72-的物质的量最小.
故选B.
点评 本题考查氧化还原反应计算等,难度中等,熟练掌握电子转移守恒思想的运用即可解答,注意从化合价的角度分析.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列关于纯净物、混合物、电解质、非电解质的正确组合为( )
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 盐酸 | 冰水混合物 | 硫酸 | 干冰 |
| B | 蒸馏水 | 碱石灰 | 氧化铝 | 二氧化硫 |
| C | 水银 | 水玻璃 | 铁 | 碳酸钙 |
| D | 食醋 | 水煤气 | 氯化铜 | 乙醇 |
| A. | A | B. | B | C. | C | D. | D |
9.下列反应中,氧化剂与还原剂的物质的量的比值从大到小的顺序排列正确的是( )
①2Na2O2+2CO2═2NaCO3+O2↑
②3S+6NaOH═2Na2S+Na2SO3+3H2O
③KClO3+6HCl═KCl+3Cl2↑+3H2O.
①2Na2O2+2CO2═2NaCO3+O2↑
②3S+6NaOH═2Na2S+Na2SO3+3H2O
③KClO3+6HCl═KCl+3Cl2↑+3H2O.
| A. | ①②③ | B. | ②①③ | C. | ①③② | D. | ②③① |
13.下列关于Cl、N、S等非金属元素单质及其化合物的说法正确的是( )
| A. | 漂白粉的成分是次氯酸钙 | |
| B. | 实验室可用浓硫酸干燥硫化氢 | |
| C. | 将浓氨水滴到氢氧化钠固体中可以制取氨气 | |
| D. | 单质氯气及单质硫与铁反应生成的产物中,铁的化合价相同 |
10.下列关于电解质、非电解质的说法正确的是( )
| A. | 氯化氢溶于水生成盐酸,盐酸是电解质,氯化氢是非电解质 | |
| B. | NH3 溶于水生成NH3•H2O,NH3•H2O是电解质,NH3是非电解质 | |
| C. | 电解质的水溶液一定能导电,非电解质的水溶液一定不能导电 | |
| D. | 液态CH3COOH不能导电,所以醋酸是非电解质 |
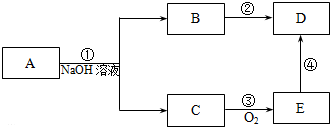
 ;
; .
.