题目内容
氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分别为:H2(g)+1/2O2(g)====H2O(l);ΔH=-285.8 kJ·mol-1
CO(g)+1/2O2(g)====CO2(g);ΔH=-283 kJ·mol-1
C8H18(l)+25/2O2(g)====8CO2(g)+9H2O (l);ΔH=-5518 kJ·mol-1
CH4(g)+2O2(g)====CO2(g)+2H2O(l);ΔH=-890.3 kJ·mol-1
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是( )
A.H2(g) B.CO(g) C.C8H18(l) D.CH4(g)
解析:本题考查反应热的计算,只要计算出1 g H2、CO、C8H18、CH4完全燃烧时,放出热量即可比较。
答案:B

练习册系列答案
相关题目

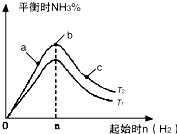 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
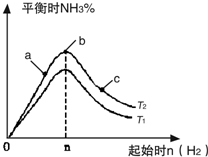 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题: