题目内容
【题目】MnO2是重要化学物质,某学习小组设计了将粗MnO2(含有较多的MnO、MnCO3和Fe2O3)样品转化为纯MnO2实验,其流程如下:
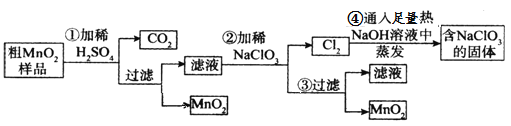
回答下列问题:
(1)第②步操作中,氧化性强弱顺序:ClO3-________(填“>”或“<”)MnO2,当NaClO3转移2 mol电子时,生成的氧化产物的物质的量为________mol。NaClO3在常温下能够与盐酸反应生成氯气,该反应的离子方程式为___________________。
(2)第④步操作中,最终得到的固体除NaClO3外,还一定含有下列物质中的_____(填字母)。
a. NaCl b. NaClO c. NaClO4 d. NaOH
(3)已知测定锰的一种方法是:锰离子转化为高锰酸根离子,反应体系中有H+、Mn2+、H2O、IO3-、MnO4-、IO4-。有关反应的离子方程式为_____________。
(4)氯酸是一种强酸,氯酸的浓度超过40%,就会迅速分解,反应的方程式为:8HClO3 = 3O2 ↑+ 2Cl2 ↑+ 4HClO4 + 2H2O,所得混合气体的平均式量为_______。
【答案】> 1 ClO3-+5Cl-+6H+=3Cl2↑+3H2O ad 2Mn2++5IO4-+3H2O=2MnO4-+5IO3-+6H+ 47.6
【解析】
粗MnO2(含有较多的MnO、MnCO3和Fe2O3)样品中加入过量的稀硫酸,由于MnO2不溶于硫酸,则样品中的MnO和MnCO3分别和硫酸反应生成可溶性的MnSO4,过滤得滤液为硫酸锰溶液,加入NaClO3发生反应为:5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+,再过滤得到滤液和二氧化锰固体,而氯气与热的氢氧化钠反应生成氯酸钠方程式为:3Cl2+6NaOH=NaClO3+NaCl+3H2O,据此分析解答。
(1)第②步中的反应为5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+,ClO3-作氧化剂,MnO2作氧化产物,则氧化性:ClO3->MnO2;当NaClO3转移2mol电子时,消耗NaClO3的物质的量=![]() =0.4mol,则生成MnO2为1mol;NaClO3在常温下与盐酸反应生成氯气,其反应的离子方程式为:ClO3-+5Cl-+6H+=3Cl2↑+3H2O,故答案为:>;1;ClO3-+5Cl-+6H+=3Cl2↑+3H2O;
=0.4mol,则生成MnO2为1mol;NaClO3在常温下与盐酸反应生成氯气,其反应的离子方程式为:ClO3-+5Cl-+6H+=3Cl2↑+3H2O,故答案为:>;1;ClO3-+5Cl-+6H+=3Cl2↑+3H2O;
(2)第④步操作中NaOH过量,发生的反应为:3Cl2+6NaOH=NaClO3+NaCl+3H2O,则最终得到的固体除NaClO3外,还有NaOH和NaCl,故答案为:ad;
(3)锰离子失电子被氧化生成高锰酸根离子,所以锰离子作还原剂,氧化剂得电子化合价降低,IO3-和IO4-中碘元素的化合价分别是+5价和+7价,所以IO4-作氧化剂,还原产物是IO3-,同时水参加反应生成氢离子,所以该反应的离子方程式为:2Mn2++5IO4-+3H2O=2MnO4-+5IO3-+6H+,故答案为:2Mn2++5IO4-+3H2O=2MnO4-+5IO3-+6H+;
(4)8HClO3 = 3O2 ↑+ 2Cl2 ↑+ 4HClO4 + 2H2O反应中混合气体中氧气和氯气的体积之比为3∶2,混合气体的平均式量 =![]() =47.6,故答案为:47.6。
=47.6,故答案为:47.6。

 中考解读考点精练系列答案
中考解读考点精练系列答案