题目内容
【题目】某些资料认为NO不能与Na2O2反应。有同学提出质疑,他认为NO易与O2发生反应,应该更容易被Na2O2氧化。
查阅资料:a.2NO+Na2O2=2NaNO2
b.6NaNO2+3H2SO4(稀)=3Na2SO4+2HNO3+4NO↑+2H2O
c.酸性条件下,NO能被MnO4-氧化成NO3-
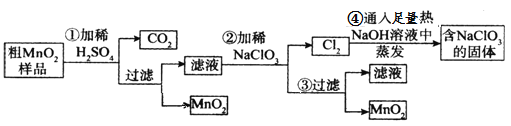
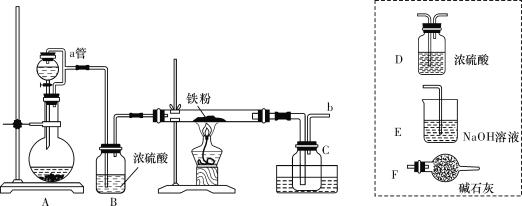
该同学利用如图中装置来探究NO与Na2O2的反应(装置可重复使用)。
(1)装置连接的顺序为A→_______________,A中生成NO的化学方程式____________;
(2)装置C的作用是_________________;
(3)装置E的作用是_________________,发生反应的离子方程式为______________;
(4)充分反应后,检验D装置中是否生成了NaNO2的实验操作是______________________。
【答案】B→C→B→D→E 3Cu+8HNO3(稀)=3Cu(NO3)+2NO↑+4H2O 检验CO2是否除尽 吸收NO防止污染空气 5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O 取装置D中反应后的少量固体于试管中,加入稀硫酸,若产生无色气体,且该无色气体在试管口上方变为红棕色,则证明生成了NaNO2
【解析】
根据实验的目的,A中制得的NO中含有少量水蒸气和二氧化碳,这两种气体能够与过氧化钠反应生成氧气,影响实验的探究,需要用碱石灰除去,经检验并干燥后,通入D装置中与Na2O2反应,最后用酸性KMnO4溶液吸收NO的尾气,并在D和E装置连接一个B装置,防止E中水气进入D中影响实验,据此分析解答。
(1)A中制得的NO中含有少量水蒸气和二氧化碳,这两种气体能够与过氧化钠反应生成氧气,影响实验的探究,需要用碱石灰除去,经检验并干燥后,通入D装置中与Na2O2反应,最后用酸性KMnO4溶液吸收NO的尾气,并在D和E装置连接一个B装置,防止E中水气进入D中,即装置的连接顺序为A→B→C→B→D→E;装置A中铜与稀硝酸反应生成NO 的反应方程式为3Cu+8HNO3(稀)=3Cu(NO3)+2NO↑+4H2O,故答案为:B→C→B→D→E;3Cu+8HNO3(稀)=3Cu(NO3)+2NO↑+4H2O;
(2)根据(1)的分析,装置C中的澄清石灰水可以检验CO2是否除尽,故答案为:检验CO2是否除尽;
(3)NO会污染空气,装置E是吸收NO防止污染空气,E中发生反应的离子方程式为5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O,故答案为:吸收NO防止污染空气;5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O
(4)亚硝酸钠和稀硫酸反应6NaNO2+3H2SO4(稀)=3Na2SO4+2HNO3+4NO↑+2H2O;充分反应后,检验D装置中是否发生反应2NO+Na2O2=2NaNO2的实验操作是:取D装置中固体少许于试管中,加入稀硫酸,若产生无色气体,2NO+O2=2NO2,生成红棕色气体二氧化氮,则2NO+Na2O2=2NaNO2发生,若气体不变色,则该反应未发生,故答案为:取D装置中固体少许于试管中,加入稀硫酸,若产生无色气体,且该无色气体在试管口上方变为红棕色,则证明生成了NaNO2,反之,未生成NaNO2。

【题目】CO2的资源化利用一直是化学家们关注的重要课题,中科院大连化学物理研究所设计了一种新型多功能复合催化剂,成功地实现了CO2直接加氢制取高辛烷值汽油:5CO2(g)+16H2(g)=C5H12(l)+10H2O(l) ΔH=+a kJ/mol (反应①),该研究成果被评价为“CO2催化转化领域的突破性进展”。
(1)已知氢气的燃烧热为286 kJ/mol,若要利用H2的燃烧热求a的值,则还需要知道一个反应的ΔH,该反应是___________。反应①在一定条件下具有自发性,则a_____0(填“>”或“<”)。
(2)向某密闭容器中按一定投料比充入 CO2、H2,控制条件使其发生反应:5CO2(g)+16H2(g)![]() C5H12(1)+10H2O(1) ΔH。 测得H2的平衡转化率与温度、压强之间的关系如图所示:
C5H12(1)+10H2O(1) ΔH。 测得H2的平衡转化率与温度、压强之间的关系如图所示:
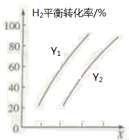
则X表示____________,Y1____________Y2(填“>”或“<”)。欲提高H2的平衡转化率并提高单位时间内C5H12(l)的产量,可采取的措施是_________(填两种)。
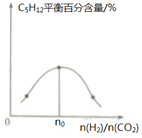
(3)控制一定温度、催化剂,按不同投料比[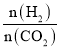 ]将反应物通入到某密闭容器中,测得平衡时C5H12的百分含量与投料比之间的关系如图所示,则n0=_____________。
]将反应物通入到某密闭容器中,测得平衡时C5H12的百分含量与投料比之间的关系如图所示,则n0=_____________。
(4)在钌一铑双金属催化剂的作用下,CH3OH、CO2、H2可高效地转化为乙酸,反应方程式为CH3OH(g)+CO2(g)+H2(g)![]() CH3COOH(g)+H2O(g) ΔH<0。一定温度下,向某刚性容器中通入等物质的量的三种原料气,测得体系中的总压强与时间的关系如表所示:
CH3COOH(g)+H2O(g) ΔH<0。一定温度下,向某刚性容器中通入等物质的量的三种原料气,测得体系中的总压强与时间的关系如表所示:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
p/kPa | 3 | 2.7 | 2.5 | 2.35 | 2.26 | 2.2 | 2.2 |
则反应开始到达平衡的过程中,v(CO2)=________kPa/min,Kp=_______span>kPa-1。
(5)碳捕捉技术的发展也有利于CO2在资源应用方面得到充分利用。常温下,若某次用NaOH溶液捕捉空气中的CO2所得溶液的pH=10,并测得溶液中c(HCO3-)=2c(CO32-),则Ka2(H2CO3)=_______mol/L。