题目内容
在一定条件下,对于密闭容器中进行的可逆反应A(g)+3B(g)
|
C.单位时间生成 n mol A,同时生成 3nmol B D. A、B、C的分子数之比为 1∶3∶2
A
解析试题分析:在一定条件下,对于密闭容器中进行的可逆反应A(g)+3B(g) 2C(g),若达到了平衡状态,各组分的浓度不变,正逆反应速率相等,则A、生成C的速率与C分解的速率相等,表明正逆反应速率相等,各组分的浓度不变,达到了平衡状态,故A正确;B、各组分的浓度相等,不能证明各组分的浓度不变,无法判断是否达到了平衡状态,故B错误;C、表示的都是逆反应速率,无法判断正逆反应速率是否相等,无法判断是否达到平衡状态,故C错误;D、各组分的分子数之比,无法判断各组分的浓度是否变化,无法判断是否达到平衡状态,故D错误;故选A。
2C(g),若达到了平衡状态,各组分的浓度不变,正逆反应速率相等,则A、生成C的速率与C分解的速率相等,表明正逆反应速率相等,各组分的浓度不变,达到了平衡状态,故A正确;B、各组分的浓度相等,不能证明各组分的浓度不变,无法判断是否达到了平衡状态,故B错误;C、表示的都是逆反应速率,无法判断正逆反应速率是否相等,无法判断是否达到平衡状态,故C错误;D、各组分的分子数之比,无法判断各组分的浓度是否变化,无法判断是否达到平衡状态,故D错误;故选A。
考点:考查化学平衡状态的判断

(16分)最近全国各地持续出现雾霾天气,其首要污染物是可吸入颗粒物PM2.5和氮、硫的氧化物(PM2.5直径接近2.5×10-6m,1纳米=10-9m),主要来源为工业废气、机动车尾气等。因此对PM2.5、SO2、NOx进行研究、处理意义重大。
(1) 下列关于PM2.5说法正确的是
a.PM2.5在空气中形成了胶体;
b.PM2.5表面积大,能吸附大量有毒、有害物质;
c.少开私家车,尽量选择公交、地铁出行,某种程度可以减少PM2.5污染
(2) 取PM2.5样本用蒸馏水处理制得试样,若测得该试样所含水溶性无机离子及其平均
浓度如下表
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/ mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(3)对汽车尾气中的NOx进行研究
①NOx能形成酸雨,写出NO2转化为HNO3的化学方程式 。
②汽车尾气系统中装有催化转化器,可将NOx还原成N2排出,已知下列热化学方程式:
ⅰ N2(g) +O2(g)
 2NO(g) △H=+180.5kJ·mol-1
2NO(g) △H=+180.5kJ·mol-1 ⅱ 2C(s)+ O2(g)
 2CO(g) △H ="-" 221.0 kJ·mol-1
2CO(g) △H ="-" 221.0 kJ·mol-1ⅲ C(s)+ O2(g)
 CO2( g) △H ="-" 393.5 kJ·mol-1
CO2( g) △H ="-" 393.5 kJ·mol-1温度升高,反应ⅲ化学平衡常数 。(填“增大”或“减小”或“不变”)
写出NO(g)和CO(g) 反应生成N2(g) CO2(g)的热化学方程式 。
(4)将工厂废气中产生的SO2通过下列流程,可以转化为有应用价值的硫酸钙等
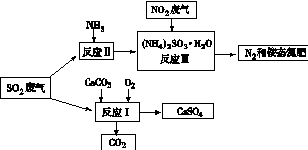
①写出反应Ⅰ的化学方程式: 。
②生产中,向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是 。
③检验经过反应Ⅲ得到的氨态氮肥中SO42-所用试剂是 。
已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。
①向其中滴加双氧水,发生反应:H2O2+2H++2Iˉ=2H2O+I2;
②生成的I2立即与试剂X反应,当试剂X消耗完后,生成的 I2才会遇淀粉变蓝因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算:H2O2+2H++2Iˉ= 2H2O+I2的反应速率。
下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
| 编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 开始变蓝时间(min) | ||||
| 0.1 mol·Lˉ1 KI溶液 | H2O | 0.01 mol·Lˉ1 X溶液 | 0.1mol·Lˉ1 双氧水 | 1 mol·L1 稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2Iˉ= 2H2O+I2反应速率的影响。实验2中m= ,n= 。
(2)已知,I2与X完全反应时,两者物质的量之比为1∶2。按表格中的X和KI的加入量,加入V(H2O2)>________,才确保看到蓝色。
(3)实验1,浓度c(X)~ t的变化曲线如图,若保持其它条件不变,请在答题卡坐标图中,分别画出实验3、实验4,c(X) ~ t的变化曲线图(进行相应的标注)。

(4)实验4表明:硫酸铁能提高反应速率。催化剂能加快反应速率是因为催化剂 (填“提高”或“降低”)了反应活化能。
(5)环境友好型铝—碘电池已研制成功,已知电池总反应为:2Al(s)+3I2(s)
 2AlI3(s)。含Iˉ传导有机晶体合成物作为电解质,该电池负极的电极反应为:________________________,充电时Al连接电源的___________极。
2AlI3(s)。含Iˉ传导有机晶体合成物作为电解质,该电池负极的电极反应为:________________________,充电时Al连接电源的___________极。(6)已知:N2H4(l) +2H2O2(l)= N2(g)+4H2O(g) △H1= -640kJ/mol
H2O(l)=H2O(g) △H2=+44.0kJ/mol
则0.25mol 液态肼与液态双氧水反应生成液态水时放出的热量是 。
100 mL 6 mol·L-1的H2SO4溶液跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
①Na2CO3溶液 ②水 ③K2SO4溶液 ④KNO3溶液
| A.①③ | B.②③ | C.①④ | D.②④ |
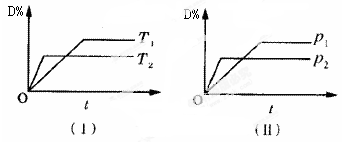
对于可逆反应mA(g)+nB(s) pC(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强p的关系如图所示,请判断下列说法正确的是
pC(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强p的关系如图所示,请判断下列说法正确的是
| A.降温,化学平衡向正反应方向移动 |
| B.使用催化剂可使D%有所增加 |
| C.化学方程式中气体的化学计量数m>p+q |
| D.B的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动 |
在下列影响化学反应速率的因素中,能使化学反应速率加快的方法是( )
①升高温度 ②加入催化剂 ③增大反应物浓度④将块状固体反应物磨成粉末
| A.①②③ | B.①②④ | C.①③④ | D.①②③④ |
保持相同的温度,可逆反应 2A (g) + B(g) 2C(g)在1×105 Pa和1×106 Pa条件下分 别达到平衡时的逆反应速率,后者与前者相比较( )
2C(g)在1×105 Pa和1×106 Pa条件下分 别达到平衡时的逆反应速率,后者与前者相比较( )
| A.大于 | B.小于 | C.等于 | D.无法确定 |
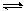
 2NH3(g) △H <0
2NH3(g) △H <0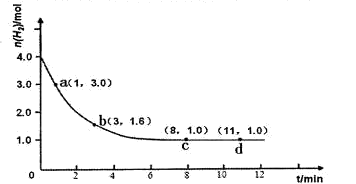
 CO+H2;②CO+H2O(g)
CO+H2;②CO+H2O(g) 