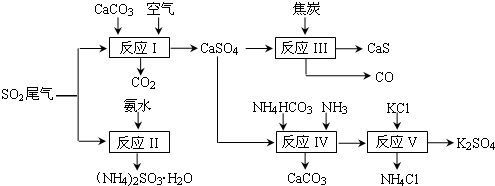
题目内容
6.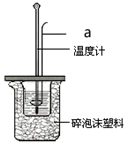 利用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液,在如图所示装置中测定中和热,回答下列问题:
利用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液,在如图所示装置中测定中和热,回答下列问题:(1)仪器a的名称是环形玻璃搅拌棒.
(2)使用下列用品不是为了减小实验误差的是A.
A.两个量筒 B.仪器a C.泡沫塑料板 D.碎泡沫塑料
(3)向装有盐酸的小烧杯中倒入NaOH溶液的正确操作是C.
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次性迅速倒入
(4)假设盐酸和氢氧化钠溶液的密度都是1g•cm-3,又知中和反应后生成溶液的比热容c=4.18J•g-1•℃-1.△t=3.4℃,该实验测得的中和热△H=-56.8kJ/mol(保留一位小数).
(5)下列操作可能会使测量的中和热数值改变的是ABC
A.用氨水代替NaOH实验
B.用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸
C.把仪器a由玻璃制品改为铜制品
D.用稀硫酸代替盐酸.
分析 (1)根据量热计的构造来判断仪器;
(2)环形玻璃棒,使溶液混合更均匀,测量更准确;碎泡沫塑料和底部垫纸条,目的是保温,以减小实验中的误差;
(3)测定中和热时,应将NaOH溶液一次迅速倒入装有盐酸的烧杯中;
(4)根据Q=m•c•△T计算出反应放出的热量,然后计算出生成1mol水放出的热量,就可以得到中和热;
(5)A.一水合氨电离要吸收热量;
B.硫酸与Ba(OH)2溶液反应除了生成水外,还生成了BaSO4沉淀,该反应中的生成热会影响反应的反应热;
C.铜棒导热,散失热量;
D.中和热测定中酸可以是稀盐酸、稀硫酸、稀硝酸.
解答 解:(1)仪器a的名称是环形玻璃搅拌棒,故答案为:环形玻璃搅拌棒;
(2)环形玻璃棒,使溶液混合更均匀,测量更准确;碎泡沫塑料和底部垫纸条,目的是保温,以减小实验中的误差;量筒是测量溶液体积的,不能减少实验误差,故选A;
(3)倒入NaOH溶液时,必须一次迅速的倒入,目的是减少热量的散失,否则会导致热量散失,影响测定结果,故选C.
(4)50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液进行中和反应,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为100mL×1g/cm3=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.4212KJ,所以实验测得的中和热△H=-$\frac{1.4212kJ}{0.025mol}$=-56.8kJ/mol,
故答案为:-56.8;
(5)A.一水合氨电离吸热,测得的热量偏小,中和热数值改变,故A正确;
B.硫酸与Ba(OH)2溶液反应除了生成水外,还生成了BaSO4沉淀,该反应中的生成热会影响反应的反应热,故B正确;
C.铜棒导热,散失热量,测得的热量偏小,中和热数值改变,故C正确;
D.用稀硫酸代替盐酸,对实验无影响,故D错误;
故答案为:ABC.
点评 本题考查中和热的测定原理、计算和注意事项,注意理解中和热的测定原理,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | 1000 mL | B. | 500 mL | C. | 100 mL | D. | 1500 mL |