题目内容
15.有镁铝混合物粉末10.2g,将它溶于500mL4mol•L-1的盐酸里,若要使沉淀质量达到最大值,则需加入2mol•L-1氢氧化钠溶液的体积为( )| A. | 1000 mL | B. | 500 mL | C. | 100 mL | D. | 1500 mL |
分析 由题意可知,酸碱恰好完全中和时产生的沉淀的质量最大,利用盐酸与氢氧化钠的反应的关系来计算.
解答 解:因产生的沉淀的质量最大,钠元素和氯元素以NaCl存在,
即相当于酸碱恰好中和时沉淀量最大,
设需加入的氢氧化钠溶液的体积为为x,
则 HCl~NaOH
1 1
0.5L×4mol/L x×2mol/L
$\frac{1}{0.5L×4mol/L}=\frac{1}{x×2mol/L}$,
解得x=1L=1000mL,
故选A.
点评 本题考查金属与酸及盐与碱反应,明确生成沉淀最大时钠与氯元素的存在形式是解答本题的关键,然后利用关系式法即可计算解答.

练习册系列答案
相关题目
20.普罗帕酮为广谱高效抗心律失常药.下列说法正确的是( )
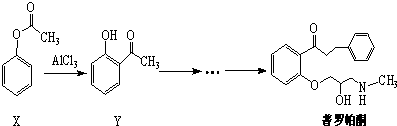

| A. | 可用溴水或FeCl3溶液鉴别X和Y | |
| B. | 反应物X与中间体Y互为同系物 | |
| C. | 普罗帕酮分子中有2个手性碳原子 | |
| D. | X、Y和普罗帕酮都能发生加成、水解、氧化、消去反应 |
3.诗句“春蚕到死丝方尽,蜡烛成灰泪始干”中“丝”和“泪”分别是( )
| A. | 纤维素、脂肪 | B. | 淀粉、油脂 | C. | 蛋白质、高级烃 | D. | 蛋白质、水 |
10.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | 石油的分馏和煤的干馏均属物理变化 | |
| B. | BaSO4在医学上用做钡餐,Ba2+对人体无毒 | |
| C. | 14C可用于文物的年代鉴定,14C与12C互为同位素 | |
| D. | 常温下铁与浓硫酸中不能反应,故通常用铁罐盛装浓硫酸 |
7.设NA表示阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 1L 1 mol/L CH3COONa溶液中存在NA个CH3COO- | |
| B. | 标况下,22.4L 甲醇中所含原子数一定为6NA | |
| C. | 1mol CnH2n+2含有(3 n+1)NA个共价键 | |
| D. | 0.1mol羟基含有的电子数为NA |
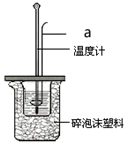 利用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液,在如图所示装置中测定中和热,回答下列问题:
利用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液,在如图所示装置中测定中和热,回答下列问题: